Virüslerin doğasının özelliği nedir? Virüslerin genel özellikleri. Viral hastalıkların patogenezi Virüslerin doğası ve çalışmaları
Amerikan Klinik Onkoloji Derneği'nin yakın zamanda San Francisco'da düzenlenen yıllık konferansında, bilim adamlarının daha önce sadece kanserli farelerde bulunan prostat kanseri hastalarının dokularında bir virüs keşfettiği sansasyonel bir rapor vardı. Ve virüs bilindiği için antitümör ilaçlarının nasıl üretileceği çok daha netleşti. Bu arada, viral kanser teorisi 1940'larda Sovyet bilim adamı Lev Zilber tarafından doğrulandı.
Üstelik bu virüs yalnızca belirli bir genetik kusuru olan hastaların dokularında bulunuyordu.
Cleveland Clinic'ten çalışmanın ortak yazarı Dr. Eric Klein, "Virüsün hastalığın doğrudan nedeni olduğunu söylemiyoruz. Ancak bu heyecan verici keşif, prostat kanserini incelemek için tamamen yeni yollara işaret ediyor" dedi.
Araştırmacılar, fare virüsünün insan vücuduna nasıl girdiğini henüz bilmiyor ancak genetik olarak kalıtsal olabileceğini öne sürüyorlar. Kaliforniya Üniversitesi'nden Dr. Klein ve meslektaşı Dr. Joe Derisi, "genetik çip" teknolojisini kullandı. Benzer bir teşhis, Rusya Bilimler Akademisi Moleküler Biyoloji Enstitüsü'nden Rus bilim adamları tarafından oluşturuldu. Derisi, özel bir plaka üzerine bilinen 20 bin virüsün genetik materyalinin karakteristik kısımlarını yerleştirdi. Klein ona prostat kanseri hastalarından 86 doku örneği verdi. Onlardan DNA örnekleri çıkarıldı ve bir çipe yerleştirildi. Mutant genin tespit edildiği 20 hastanın DNA'sı, fare onkovirüsünün DNA'sı ile çakıştı. Mutasyon, vücudu istila eden virüsleri yok eden enzimlerin üretimini kodlayan bir genin kopyalanmasıdır.
Çift gene sahip erkeklerin bu enzimlerden önemli ölçüde daha az ürettiği ortaya çıktı. Normal gene sahip 66 hastadan sadece birinde virüs tespit edildi. Bilim insanları, virüsün varlığı ile prostat kanseri arasındaki bağlantıyı açıklığa kavuşturmak için yüzlerce hasta ve sağlıklı insanı incelemeyi planlıyor.
Amerikalı bilim adamlarının keşfi, Lev Zilber tarafından yirminci yüzyılın 40'lı yıllarında formüle edilen virüsogenetik kanser teorisinin bir başka pratik onayı haline geldi.
Lev Zilber, kanserin kökenine dair teoriyi hapishanede bilim dünyasından yarım asır önce ortaya çıkardı
Lev Zilber'in oğlu Akademisyen Lev Kiselev, İzvestia'nın sorularını yanıtlıyor.
Lev Aleksandrovich'in teorisini 40'lı yıllarda kampta oluşturduğu biliniyor. Ancak viral hipotez daha önce ifade edilmiş miydi?
Kanserin viral doğası hakkındaki ilk hipotezler yirminci yüzyılın başında yurttaşımız Ilya Mechnikov da dahil olmak üzere ifade edildi. Ancak Lev Zilber, zamanının çok ilerisinde olan bütünsel bir virogenetik teori formüle etti.
- Peki çağdaşlar yeni teoriyi kabul etmediler mi?
Evet, 20 yıl boyunca tek başına haklı olduğunu kanıtladı. Teorinin ilk deneysel onayı ancak 60'lı yıllarda ortaya çıktı. Çekoslovakya Genetik Enstitüsü'nden Çek Jan Svoboda'nın çalışmaları büyük destek sağladı, kendisi hala hayatta.
- Bugün Lev Alexandrovich'in doğruluğu konusunda hiçbir şüphe yok mu?
Bugün tüm kanserlerin% 25'e kadarının onkovirüslerin katılımıyla ortaya çıktığına inanılmaktadır. Bu, özellikle kronik hepatit B ve C virüslerinin neden olduğu karaciğer kanseri ve rahim ağzı kanseri (insan papilloma virüsü) için kanıtlanmıştır. Meme kanseri, mide kanseri ve diğerleri gibi hastalıkların virüslerin katılımı olmadan ortaya çıkmadığı yönünde öneriler var. Ayrıca hayvanlardaki tüm tümörlerin virüslerden kaynaklandığı kanıtlanmıştır. Babamın "kanser genomun bir hastalığıdır" sözleri kehanet gibi çıktı çünkü o zamanlar genomu deşifre etmek inanılmaz derecede uzaktaydı.
Büyük bilim adamı, parlak adam
Lev Zilber 1894'te Pskov'da doğdu. Tıp Fakültesinden mezun olduktan sonra Moskova ve Bakü'de çalıştı, SSCB'de vebanın yok edilmesine katıldı ve hastalık virüsünün keneler tarafından bulaştığını öne süren kene kaynaklı ensefalit teorisini geliştirdi. Saçma suçlamalarla iki kez hapse atıldı (1937-39 ve 1940-44'te). Kardeşi yazar Veniamin Kaverin ve "Sovyet penisilini"nin yaratıcısı olarak bilinen eski eşi Zinaida Ermolyeva, onun serbest bırakılması için özverili bir şekilde mücadele etti. Kardeşin, Kaverin'in milyonlarca insan tarafından sevilen "İki Kaptan" hikayesinden Sanya Grigoriev'in prototipini oluşturduğu biliniyor. "Açık Kitap" romanı Ermolyeva'ya ithaf edilmiştir.
Zilber, kanserin kökenine dair teorisini hapishanede oluşturdu ve bilimsel bir "sharashka" üzerinde deneyler yaptı. Ödemesini tütünle yaptığı mahkumlar tarafından onun için fareler ve fareler yakalandı. Tümör gelişiminin mekanizmalarını inceleyen Zilber, bir virüsün sağlıklı bir hücreye girdiğinde genetik temelini değiştirdiği, böylece hücrenin vücudun kontrolünün ötesine geçtiği ve engellenmeden bölünmeye başladığı sonucuna vardı - bir tümör bu şekilde ortaya çıkar. Lev Aleksandrovich teorisiyle ilgili ilk makaleyi 1945 yılında gazetemizde yayınladı. Aynı yıl bu konuyla ilgili monografisi ortaya çıktı.
Kaynak:
Sağlık alanındaki diğer makaleler:
| 14 Aralık 2016 |
20 Mayıs 2016 |
17 Mayıs 2016 |
| 22 Kasım 2015 |
Virüsler Rus botanikçi D.I. Ivanovsky (1864 – 1920) 1892'de tütün yapraklarındaki mozaik hastalığını incelerken. “Virüs” terimi ilk kez 1898'de Hollandalı bilim adamı M. Beijerinck (1851 – 1931) tarafından önerildi.
Şu anda yaklaşık 3.000 farklı virüs türü bilinmektedir.
Virüslerin boyutları 15 ila 350 nm arasında değişir (bazı filamentli olanların uzunluğu 3.000 nm'ye ulaşır; 1 nm = 1.10–9 m), yani. bunların çoğu ışık mikroskobunda (mikroskobik olarak) görülemiyor ve bunların incelenmesi ancak elektron mikroskobunun icadından sonra mümkün oldu.
Virüslerin diğer tüm organizmalardan farklı olarak hücresel bir yapısı yoktur!
Olgun viral parçacık (yani hücre dışı, dinlenme – virüs) yapısı çok basittir: bir veya daha fazla nükleik asit molekülünden oluşur. çekirdek virüs ve protein kabuğu (kapsid)- bunlar sözde basit virüsler.
Karmaşık virüsler(Örneğin, uçuk veya nezle) ayrıca kapsid proteinleri ve nükleik asit ilave içerir lipoprotein zar(zarf, konakçı hücrenin plazma zarından oluşan süperkapsid), çeşitli karbonhidratlar Ve enzimler(Şekil 3.1).
Enzimler viral NK'nin hücreye nüfuzunu ve ortaya çıkan virionların çevreye salınmasını kolaylaştırır ( nöraminidaz Miksovirüsler, ATPaz Ve lizozim bazı fajlar vb.) ve ayrıca viral NK'nin (çeşitli) transkripsiyon ve replikasyon işlemlerine katılır transkriptazlar Ve kopya).
Protein kabuğu nükleik asidi çeşitli fiziksel ve kimyasal etkilerden korur ve ayrıca hücresel enzimlerin içine nüfuz etmesini önleyerek parçalanmasını önler (koruyucu fonksiyon). Ayrıca kapsid, enfekte olmuş hücrenin reseptörünü tamamlayıcı olan bir reseptör içerir; virüsler, kesin olarak tanımlanmış bir konakçı aralığını enfekte eder (fonksiyonu tanımlar).
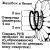
Virionlar birçok bitki virüsü ve bir takım fajlar sarmal protein alt birimlerinin (kapsomerler) bir eksen etrafında spiral şeklinde düzenlendiği bir kapsid. Örneğin, VTM ( tütün mozaik virüsü) 15-17 nm çapında ve 300 nm'ye kadar uzunlukta çubuk şeklindedir (Şekil 3.2.). Kapsidinin içinde 4 nm çapında içi boş bir kanal vardır. TMV'nin genetik materyali Pirinç. 3.2.
Tütün mozaik virüsünün yapısı. Helisel kapsidin oluğunda sıkıca paketlenmiş tek sarmallı RNA vardır. İçin virüsler sarmal kapsidli olması, yüksek protein içeriği (%90 – 98) ile karakterize edilir.
Helisel kapsidin oluğunda sıkıca paketlenmiş tek sarmallı RNA vardır. İçin virüsler sarmal kapsidli olması, yüksek protein içeriği (%90 – 98) ile karakterize edilir.
Birçok virüsün virionlarının kapsidleri (örneğin, adenovirüs, virüs uçuk, sarı virüs şalgam mozaikleri– VZhMT) simetrik bir çokyüzlü, çoğunlukla bir ikosahedron (12 köşesi, 20 üçgen yüzü ve 30 kenarı olan bir çokyüzlü) şekline sahiptir. Bu tür kapsidlere denir eş ölçülü(Şekil 3.3.). Bu tür viryonlarda protein içeriği NK'ye göre yaklaşık %50'dir.

Bir virüs her zaman bir tür nükleik asit içerir (DNA veya RNA), bu nedenle tüm virüsler DNA içeren ve RNA içeren olarak ikiye ayrılır. Viryondaki nükleik asit molekülleri doğrusal (RNA, DNA) veya halka şeklinde (DNA) olabilir. Üstelik bu nükleik asitler bir veya iki zincirden oluşabilir. Viral NK'nin 3 ila 200 geni vardır.
Virüsün nükleik asidi, her iki asidin (DNA ve RNA) işlevlerini birleştirir - kalıtsal bilgilerin depolanması ve iletilmesinin yanı sıra protein sentezinin kontrolü.
Virüslerin aksine, tüm hücresel organizmalar her iki tip nükleik asidi de içerir.
Bakteriyel virüsler daha karmaşık bir yapıya sahiptir – bakteriyofajlar(Şekil 3.4.). Bir baş ve kuyruktan (çubuk ve kılıf, bazal plaka ve işlem filamentleri) oluşurlar. Uzun bir NA molekülü (RNA veya DNA), bakteriyofaj kafasının (protein kabuğu) içinde bir spiral şeklinde katlanır.
Virüsler ayrıca şunları içerir: viroidler– kendi proteinlerini kodlamayan (kapsid içermeyen) düşük molekül ağırlıklı (kısa) tek sarmallı dairesel RNA'lar olan bulaşıcı ajanlar. Pek çok hastalığın etken maddeleridirler.
İLE

İÇİNDE
Pirinç. 3.4.
Bir bakteriyofajın yapısı. Sürecin konuları
Bilim insanları virüslerin yaklaşık 3 milyar yıl önce organizmaların nükleik asitlerinden ortaya çıktığına inanıyor (prokaryotlar) bir protein kabuğunu sentezleme ve hücrelerin içinde bölme (çiftleme, kopyalama) yeteneğini kazanmış genomdan serbest parçaların izolasyonu sonucunda. Halen bakteri genomundan yeni tip virüslerin oluştuğuna inanılmaktadır. ökaryotlar(çekirdekler, plastidler, mitokondri) .
Doğada virüsler, her yerde bulundukları ve tüm canlı organizma gruplarını etkileyerek sıklıkla çeşitli hastalıklara neden oldukları için büyük önem taşımaktadır.
1000'den fazla hastalık biliniyor bitkiler virüslerin neden olduğu (RNA içeren). En yaygın olanları çeşitlidir nekroz(ölü doku alanları), mozaikler(bitki organlarında lekeler, lekeler, çizgiler), parankim dokusunun hasar gördüğü, kloroplast sayısının azaldığı, floemin tahrip olduğu vb.; buruşuk veya bodur yapraklar görülür. Virüsler bitki büyümesinin durmasına neden olur ve bu da verimin azalmasına neden olur.
VZhMT – şalgam sarı mozaik virüsü, VTM – tütün mozaik virüsü, VKKT – domates cüce çalılık virüsü.
Bazı lale çeşitlerinin (alacalı) çiçeklerindeki şeritlerin görünümü de bir virüsten kaynaklanır, ancak çiçek yetiştiricileri bu laleleri özel bir çeşit olarak satarak satarlar.
sen hayvanlar virüsler (DNA ve RNA içeren) aşağıdaki gibi hastalıklara neden olur: ayak ve ağız hastalığı(sığırlarda) kuduz(köpeklerde, tilkilerde, kurtlarda), miksomatoz(farelerde) sarkom, lösemi Ve veba(tavuklarda) vb. Çoğu zaman insanlara bu hastalıklar bulaşır (enfekte hayvanlarla temas yoluyla).
sen kişi Virüsler aşağıdaki gibi hastalıklara neden olur: Çiçek hastalığı(variola virüsü) domuzcuk(paramiksovirüs), nezle(miksovirüs), solunum hastalıklar(ARI; rinovirüsler RNA-), bulaşıcı hepatit, çocuk felci(çocukluk felci; pikornavirüs), kuduz, uçuk, AIDS(insan bağışıklık yetersizliği virüsü - HIV).
Nezle - insan hayatı için tehlikeli olan periyodik küresel salgınlar şeklinde kendini gösteren tek bulaşıcı hastalıktır. İnfluenza virüsünün bulaşıcı özellikleri (solunum yolunun mukoza zarlarını etkiler), diğer virüsler gibi, rekombinasyonlar veya mutasyonlar sonucu sürekli değişen viral zarfın spesifik proteinlerine bağlıdır. Bu nedenle grip virüsünün yeni türleri, insanlar henüz onlara karşı bağışıklık geliştirmediği için yeni salgınlara neden oluyor.
Böylece 1968/69 kışında ABD'de 50 milyon vaka kaydedildi. Hong Kong gribi 70.000 kişi ise öldü. 1918/19 salgını tüm dünyayı kasıp kavurdu, üç dalga halinde meydana geldi ve 20 milyon insanın hayatına mal oldu.
Virüsler antibiyotiklere duyarlı olmadığından viral hastalıkların tedavisi zordur. Neyse ki çoğu durumda bağışıklık sistemi enfeksiyonun daha fazla yayılmasını sınırlar.
İnsanlarda ve hayvanlarda görülen çok sayıda viral hastalık şu yöntemlerle önlenebilir: aşılama– virüslere karşı bağışıklık geliştirmenize olanak tanıyan koruyucu aşıların yapılması.
Virüsler insanlar tarafından mikrobiyolojik araştırmalarda (biyoteknoloji, genetik mühendisliği) yaygın olarak kullanılmaktadır. Mahsul zararlılarını kontrol etmek için virüsleri kullanmak mümkündür.
ABD'de ile pamuk kozası Virüsün yardımıyla etkili bir şekilde mücadele edin. Bu kontrol yöntemi pratik olarak zararsızdır - virüs, kural olarak türe özgüdür (yani yalnızca belirli bir organizma türünü etkiler).
Ayrıca örneğin şu tespit edildi: pirinç nekrotik mozaik virüsü pirincin büyümesini engeller. Ancak diğer bitkiler, örneğin jüt(torbalar ve ipler için kaba lif kaynağı), bu virüsten etkilendiklerinde sağlıklı olduklarından daha iyi büyürler. Bilim insanları bu olguyu henüz açıklayamıyor.
Bakteriyofajlar, patojenik olanlar da dahil olmak üzere bakterileri enfekte eder (onlara nüfuz eder ve aktif olarak yok eder). Bu nedenle birçok bulaşıcı hastalığın önlenmesi ve tedavisinde ve patojen bakterilerle mücadelede bunları kullanmak mümkündür: veba, tifo, kolera ve benzeri.
Ders 1
Virüslerin doğası, kökeni ve yapısı.
Modül 1
Modülün entegre amacı
Modülün kapsamlı amacı öğrencilere virüslerin temel özelliklerini anlamalarını sağlamaktır: viral parçacıkların doğası, kökeni, mimarisi ve morfolojisi, simetri türleri ve virüslerin kimyasal özellikleri. Bu bilgi, üreme süreçlerinde ve viral patogenezde ifade edilen virüslerin biyolojik özünün daha iyi anlaşılması için teorik bir temel oluşturmalıdır. Modül, materyali belirlenen hedefi çözmenize olanak tanıyan üç dersten oluşur.
VİRÜSLERİN DOĞASI
Virüslerin keşfinden günümüze kadar virüslerin doğasına ilişkin fikirler önemli değişikliklere uğramıştır.
D.I. Ivanovsky ve o zamanın diğer araştırmacıları, virüslerin genel mikroorganizma kütlesinden izole edilmesini mümkün kılan iki özelliğini vurguladılar: filtrelenebilirlik ve tüm yapay besin ortamlarında çoğalamama. Daha sonra bu özelliklerin mutlak olmadığı ortaya çıktı, çünkü filtrelenebilir bakteri ve mikoplazma formlarının yapay besin ortamlarında yetiştiği ve boyut olarak en büyük virüslere (insan ve hayvan çiçek hastalığı virüsleri) yaklaştığı keşfedildi.
Ancak entegrasyonun gerçekleşmediği ve viral genomun otonom durumda olduğu durumlarda bile enfeksiyonun ortaya çıkması, viral ve hücresel genomlar arasındaki rekabetten kaynaklanmaktadır.
Virüsün benzersiz özellikleri, diğer tüm hücrelerin ve organizmaların üreme yöntemlerinden (ikili fisyon, tomurcuklanma, spor oluşumu) keskin bir şekilde farklı olan üreme yöntemini içerir. Virüsler büyümez ve bunların üremesine, uzaydaki (hücrenin topraklarında) ayrılığı ve sonraki montaj ve oluşum ile viral bileşenlerin (nükleik asitler ve proteinler) sentezlenme zamanını vurgulayan ayrık (ayrılmış) üreme denir. viryonlardan oluşur.
Yukarıdakilerle bağlantılı olarak, virüslerin ne olduğu - canlı ya da cansız, organizmalar ya da organizma olmayanlar - hakkında birçok kez tartışmalar ortaya çıkmıştır. Elbette virüsler diğer tüm yaşam formlarının temel özelliklerine sahiptir: üreme yeteneği, kalıtım, değişkenlik, çevre koşullarına uyum sağlama yeteneği; belirli bir ekolojik niş işgal ederler, dünyadaki organik dünyanın evrim yasalarına tabidirler. Bu nedenle 40'lı yılların ortalarında virüslerin en basit mikroorganizmalar olduğu fikri gelişti. Bu görüşlerin mantıksal gelişimi, hücre dışı viral bireyi ifade eden "virion" teriminin tanıtılmasıydı. Ancak virüslerin moleküler biyolojisi üzerine yapılan araştırmaların gelişmesiyle birlikte, virüslerin organizma olduğu fikriyle çelişen gerçekler birikmeye başladı.
Kendi protein sentezleme sistemlerinin yokluğu, ayrık bir üreme şekli, hücresel genomla entegrasyon, uydu virüslerinin ve kusurlu virüslerin varlığı, çoklu yeniden aktivasyon ve tamamlama olgusu - tüm bunlar şu fikire pek uymuyor: Organizmalar olarak virüsler. Bu fikir, virüs benzeri yapılara (plazmidler, viroidler ve scrapie patojeni gibi ajanlar) döndüğümüzde daha da anlamını yitiriyor.
Plazmidler (diğer isimler - epizomlar, epivirüsler), hücre tarafından kopyalanan, birkaç milyon moleküler ağırlığa sahip çift sarmallı dairesel DNA'dır. İlk olarak prokaryotlarda keşfedildiler ve varlıkları bakterilerin antibiyotik direnci gibi çeşitli özellikleriyle ilişkilendiriliyor. Plazmitler genellikle bakteri kromozomu ile ilişkili olmadığından (birçoğu entegrasyon yeteneğine sahip olmasına rağmen), kalıtımın kromozom dışı faktörleri olarak kabul edilirler.
Plazmitler aynı zamanda ökaryotlarda da (maya ve diğer mantarlar) keşfedilmiştir; ayrıca yüksek hayvanların sıradan virüsleri de kendi proteinlerinden yoksun ve hücresel DNA sentez enzimleri tarafından kopyalanan plazmidler, yani dairesel DNA formunda mevcut olabilir. Özellikle sığır papillomavirüsleri ve simian virüsü 40 (SV-40), plazmit formunda mevcut olabilir. Herpes virüsü hücre kültüründe varlığını sürdürdüğünde, bu virüsün genomunun yalnızca bir kısmını oluşturan plazmitler (dairesel DNA) oluşturulabilir.
Virüslerle ilgili olan viroidler, 1972'de T. O. Diner tarafından keşfedilen, bazı bitkilerde hastalıklara neden olan ve sıradan bulaşıcı virüsler gibi bulaşabilen ajanlardır. Bunları incelerken, bunların birkaç 300-400 nükleotidden oluşan nispeten küçük dairesel süper sarmal RNA molekülleri olduğu ortaya çıktı. Viroid replikasyonunun mekanizması tamamen açık değildir.
Son olarak, koyunlarda subakut bulaşıcı süngerimsi ensefalopatinin etken maddesi olan ajan scrapie'den bahsetmek gerekir. Muhtemelen, benzer ajanlar hayvanlarda ve insanlarda sinir hücrelerinin ilerleyici tahribatına dayanan diğer süngerimsi ensefalopati formlarına neden olur ve bunun sonucunda beyin süngerimsi (süngerimsi) bir yapı kazanır. Scrapie ajanı protein yapısına sahiptir ve hatta özel bir isim almıştır - prion (proteinli bulaşıcı parçacık - protein bulaşıcı parçacık kelimelerinden). Bu proteinin hem bir indükleyici hem de özerk hale gelmiş ve düzenlemeden kaçmış (“çıldırmış”) bazı hücresel genlerin bir ürünü olduğu varsayılmaktadır.
Uydu ve kusurlu virüsler, plazmidler, viroidler ve hatta scrapie ajanları (genleri) dahil olmak üzere tüm virüslerin, onları birleştiren ortak bir noktası vardır. Hepsi, bunlara duyarlı hayvan, bitki, protozoa, mantar ve bakteri hücrelerinde çalışabilen ve çoğalabilen otonom genetik yapılardır. Görünüşe göre bu, virüs krallığının ana hatlarını çizmemize olanak tanıyan en genel tanımdır. Formüle edilen tanıma göre virüsler organizma olmasalar da benzersiz bir yaşam biçimidir ve bu nedenle yeryüzündeki organik dünyanın evrim yasalarına uyarlar.
VİRÜSLERİN KÖKENİ
Virüslerin kökenine ilişkin çeşitli varsayımlar yapılmıştır. Bazı yazarlar virüslerin, bakterilerin veya diğer tek hücreli organizmaların gerileyen evriminin aşırı bir tezahürünün sonucu olduğuna inanıyordu. Gerileyen evrim hipotezi, virüslerdeki genetik materyalin çeşitliliğini, bunların hücresel olmayan organizasyonunu, ayrık üreme biçimini ve protein sentezleme sistemlerinin yokluğunu açıklayamaz. Bu nedenle, şu anda bu hipotez oldukça tarihsel bir öneme sahiptir ve virologların çoğunluğu tarafından paylaşılmamaktadır.
İkinci hipoteze göre virüsler, biyolojik evrimin başladığı hücresel yaşam formlarının ortaya çıkışından önce gelen eski, hücre öncesi yaşam formlarının - protobiyontların torunlarıdır. Bu hipotez şu anda virologların çoğunluğu tarafından da paylaşılmıyor çünkü ilk hipotezin çözemediği sorunları açıklamıyor.
Üçüncü bir hipotez, virüslerin, hücrelerin özerk hale gelen genetik öğelerinden evrimleştiğini öne sürüyor; ancak bu öğelerden hangisinin, virüslerde bu kadar geniş bir genetik materyal çeşitliliğine yol açtığı açık değil. İronik bir şekilde "akan genler" hipotezi olarak adlandırılan bu hipotez, en fazla sayıda destekçi bulmaktadır, ancak ifade edildiği orijinal formda değildir, çünkü virüslerdeki genetik materyal formlarının (tekli-tekli) varlığını açıklamamaktadır. sarmallı DNA, çift sarmallı RNA), hücrelerde bulunmaması, kapsid oluşumu, iki simetri formunun varlığı vb.
Virüslerin aslında hücrelerin genetik öğelerinin türevleri olması muhtemeldir, ancak hücresel yaşam formlarının ortaya çıkışı ve evrimiyle birlikte ortaya çıkmış ve evrimleşmişlerdir. Doğa, genetik materyalin tüm olası formlarını (farklı RNA ve DNA türleri) virüsler üzerinde denedi ve sonunda kanonik formunu seçti - bakterilerden insanlara kadar tüm hücresel organizma formlarında ortak olan çift sarmallı DNA. Bir yandan özerk genetik yapılara sahip, diğer yandan dış hücre geliştirme yeteneğinden yoksun olan virüsler, milyarlarca yıllık biyolojik evrim boyunca o kadar farklı gelişim yolları izlemişlerdir ki, kendi gruplarının birbirleriyle ardışık bir bağlantısı yoktur. birbirine göre. Görünüşe göre, farklı virüs grupları, tarihsel olarak farklı zamanlarda hücrelerin farklı genetik elemanlarından ortaya çıkmıştır ve bu nedenle şu anda mevcut olan farklı virüs grupları polifiletik bir kökene sahiptir, yani tek bir ortak ataları yoktur. Ancak genetik kodun evrenselliği virüsler için de geçerli olup, onların da yeryüzünün organik dünyasının bir ürünü olduklarını göstermektedir.
VİRÜSLERİN EVRİMDEKİ ROLÜ
Yaşamın özel formları olan virüsler mikroorganizmalar olmadığından viroloji, mikrobiyolojinin bir dalı değil, kendi çalışma konusu ve kendi araştırma yöntemleri olan bağımsız bir bilimsel disiplindir.
Virüslerin doğası ve kökeni
İnfluenza virüsünün antijenik değişkenliği ve çalışmasının yönleri.
İnfluenza virüsünün etkili zayıflatılmış varyantlarını elde etme çözümü, antijenik özelliklerinin benzersiz esnekliği ve değişkenliği nedeniyle engellenmektedir. Çeşitli aralıklarla neredeyse yıllık grip salgınları küresel hale geliyor. Son yıllarda pandemilere neden olan enfeksiyonun influenza A virüsü olduğu, her üç tipindeki antijenik değişimlerin analizi, AO tipi virüs suşlarının antijenik kompozisyonunda A tipine geçişin kademeli olarak gerçekleştiğini ve A1 tipinden geçişin yavaş yavaş gerçekleştiğini göstermektedir. A2'ye keskindi.
1957'de doğada yeni bir serolojik tip A2'nin ortaya çıktığı kaydedildikten sonra, küçük değişiklikler olmasına rağmen bir süre stabil görünüyordu. Ancak 1964'te önemli hale geldiler ve Hong Kong'daki salgından sonra virüsler o kadar dramatik bir şekilde farklılaştı ki, yeni bir A tipi antijenin ortaya çıktığı varsayıldı.Virüsün evrimi sırasında, yalnızca yüzey proteinlerinin antijenik özellikleri değişmedi. , aynı zamanda diğer özellikler. 1971-1972 salgını sırasında izole edilen influenza virüsü suşu, daha önce dolaşımda olan suşların aksine, üreme ve nöraminidaz aktivitesini önemli ölçüde arttırdı, virüslerin termostabilitesini keskin bir şekilde arttırdı ve farelerde düzenli olarak viremiye neden olma yeteneği kazandı (Zakstelskaya ve diğerleri, 1969). ; Sokolov, Podchernyaeva, 1975).
Daha önce B tipi virüsler nispeten stabil idiyse, 1967'den beri sürekli bir değişim olmuştur (Seihachiro, Mitsuo, 1974). Nisan-Mayıs 1974'te, B/Hong Kong 15/72'nin yeni bir varyant olarak kabul edildiği ve diğerlerinin eski ve yeni türler arasında orta düzeyde olduğu kabul edilen influenza virüsünün yeni türleri izole edildi; İnfluenza B virüsünün antijenik stabilitesi ve yeni bir serotipin ortaya çıkmasını düşündürmektedir.
Böylece A ve B tipleri arasında önemli antijenik değişikliklerin olduğu bir tablo ortaya çıkıyor. Bu durum doğal olarak grip sorunu üzerinde çalışan bilim adamlarının da yakından ilgisini çekiyor. Popülasyonda yoğun bağışıklığın varlığı bile influenza virüsünde bu kadar büyük antijenik değişikliklere neden olamayacağından, insan ve hayvan influenza virüslerinin yanı sıra insan ve kuş virüsleri arasında meydana gelen rekombinasyonların periyodikliği hakkında bir hipotez öne sürüldü. Bu hipotezi geliştirirken gribin doğal olarak domuzları, atları, hindileri, tavukları, ördekleri, sumruları etkilediği ortaya çıktı ve bu liste büyümeye devam ediyor. Kan serumlarında insan influenza virüslerine karşı antikorlar bulunur. İnfluenza virüsü genomunun parçalanması sadece tür içi değil aynı zamanda türler arası rekombinasyon olasılığını belirlediğinden bu şaşırtıcı değildir.
Nöraminidaz ve hemaglutinin'in hazırlık niteliğinde ayrılması, bireysel özellikler arasındaki ilişkinin derinlemesine analizi için umutlar açar. Bazı araştırmacılar (Webster a. o., 1973; Gorev ve diğerleri, 1974), rekombinant virüsün hemaglutinin ile eşzamanlı olarak virülans kazandığını belirtmektedir. Belirtilen hemaglutinin ve nöraminidaz içeren bir dizi rekombinant vardır.
Şu anda dünya çapında birçok viroloji laboratuvarı influenza epizootikleri üzerinde çalışıyor ve insan influenza ile antijenik ilişkileri analiz ediyor. Bu yöndeki çalışmalar DSÖ tarafından koordine edilmekte ve teşvik edilmektedir. Bu sorunun karmaşıklığı, çözümüne yönelik belirsiz bir yaklaşım ihtiyacını zorunlu kılmaktadır. Bu konuya yönelik diğer yaklaşımlara yönelik paralel arayışlar alternatif olarak değerlendirilmemelidir.
40-50'li yıllarda, virüsün aşılanmış hayvanların vücuduna geçişi sırasında antijenik varyantların ortaya çıktığı deneysel olarak kanıtlanmıştır (Archetti, Horsfoll, 1960). Bu değişiklikler oldukça kalıcıydı; virüsler, yumurtadaki seri pasajlarda ve immünserumun yokluğunda yeni antijenik spesifikliklerini koruyorlardı. Üstelik influenza virüsünün aşılanmamış sağlıklı hayvanların vücutlarından uzun süreli geçişi biyolojik özelliklerini değiştiriyor. Örneğin, K. Paucker (1960), PR8 suşunun geçişleri sırasında uzun süre antijenik olarak orijinalinden farklı olan ve diğer influenza virüsü türlerine benzemeyen bir virüs aldı. Yazar, 103 ve 107. pasajlar arasında, daha sonra orijinal virüsün yerini alan bir mutantın oluştuğuna inanıyor. Benzer veriler K. Zgozelska ve diğerleri (1973) tarafından da sağlanmaktadır.
Burada viral olanlar da dahil olmak üzere herhangi bir popülasyonun temel gelişim yasasının bir tezahürünü görüyoruz - bir popülasyonun gen havuzu zamanla değişir: bir yandan bireysel genleri içeren organizmaların yok olması sonucu tükenir, bir yandan da yeni genlerin oluşmasına neden olan mutasyonlar nedeniyle zenginleşir.
S. Fazekas de Sent Groth, C. Hannoun'un (1973) "immünopress" altında (yani immünserum varlığında) influenza A virüsünün spontan antijenik mutantlarının seçimi üzerine çalışması, hiyerarşik düzenin yeniden üretilmesini mümkün kıldı. Her türün içindeki virüsler. Üstelik tüm sonuçlarında kesitsel RZGA göstergelerine dayanıyordu. Antikorların yardımıyla elde edilen geç mutantların seçimine ilişkin deneylerde, salgın suşların doğal seçim sürecini yeniden üretmeyi başardı. Ayrıca bir antikorun bir antijenle etkileşiminin basit bir modelini de önerdi. Yazar, virüsün protein kabuğunun antijenik bölgesini, virüs yüzeyinin dışına çıkan az sayıda amino asit protein zinciri şeklinde sundu. Şematik olarak farklı uzunluk ve genişlikte dişlere sahip bir çatala benziyor ve karşılık gelen antikorlar, dişlerin bir kısmını veya tamamını tamamlayan boşluklardır. Böylece, antiserumun ilgili bir antijenle teması, homolog antijenlerin ortadan kaldırılmasına yol açar ve tamamlayıcı olmayan bölgelere sahip antijenler, yani mutantlar, popülasyonda kalır.
Bu diyagram, antijen ve antikor etkileşimi ve antikor biyosentezi teorisi hakkında 40'lı yıllarda ortaya çıkan immünolojinin temel ilkelerinin mantıksal gelişimini temsil etmektedir. Bu çalışmalara göre aktif antikor grubu, antijenin belirleyici grubunun konfigürasyonuna ek bir konfigürasyona sahiptir. Bu grupların birbirleriyle, bir nesnenin aynadaki görüntüsüyle ilişki kurması gibi ilişki kurduğu varsayılmıştır. K. Landsteiner (1946), protein moleküllerinin çeşitli düşük moleküler bileşiklerle kompleksleştirilmesiyle elde edilen yapay bir antijenle deneyler yaptı; bu, bu antijenin özgüllüğünün yalnızca proteine bağlı küçük bir grup tarafından belirlenebileceğini gösterdi. Antikorlar, bir antijeni yalnızca aromatik halkadaki metil grubunun pozisyonunda bu antikorların oluşumunu uyaran gruptan farklıysa veya hidroksilin uzaysal pozisyonunda farklıysa "tanımaz" (Boyd 1969).
Böylece virüsün antijenik değişkenliği konusuna dönecek olursak, bu süreçte antikorların seçim rolünü söyleyebiliriz. Bir viral popülasyonda mutant parçacıkların nasıl ortaya çıktığı, influenza virüslerinin evrimini anlamak için cevaplanması gereken sorulardan biridir.
Herhangi bir viral popülasyon, dış veya iç faktörlerin etkisi sonucu ortaya çıkan spontan mutantları içerir. Kazanılan özelliklere bağlı olarak bir mutant üremede avantaja sahip olabilir ve popülasyonda baskın olabilir. Bazı durumlarda mutantın ortaya çıkmasında belirleyici rol oynayan faktörü tespit etmek mümkün olabiliyor. 1918 salgını, virüsün insanlar için son derece patojen olması nedeniyle grip sorunuyla ilgilenen araştırmacıların büyük ilgisini çekiyor. Bu virüsün retrospektif analizi, bazı araştırmacıları, pandeminin 1930'da izole edilen bir domuz gribi virüsünün neden olduğuna inanmaya yöneltti; çünkü suşlar, domuz virüsleriyle ilişkili antijenlere sahipti. Diğer bir bakış açısına göre virüs aktivitesindeki artış, Birinci Dünya Savaşı sırasında, yani pandemik grip dalgasından önce kullanılan hardal gazının etkisi altında mutant parçacıkların ortaya çıkmasından kaynaklanmaktadır (Blashkovich 1966). Aslında hardal gazı son derece güçlü biyolojik olarak aktif bir kimyasal maddedir. Mutajenik aktivitesi ilk olarak C. Auerbach ve T. M. Robson (1946) tarafından gösterilmiştir. Aynı zamanda hardal gazının kromozomlar üzerinde doğrudan mutajenik etkiye sahip olduğu da tespit edildi. Daha sonra hardal gazının virüs ve bakterilerde mutasyonlara neden olabileceği keşfedildi. Sonuç olarak, kimyasal ve fiziksel faktörlerin gelişimin tüm aşamalarında biyolojik nesnelerde genetik değişikliklere neden olabileceğini ve görünüşe göre virüslerin de bir istisna olmadığını dikkate alırsak, mutajenik bir ajan olarak olası rolü göz ardı edilemez.
Doğal koşullar altında mutajen görevi görebilen faktörler arasında farmakolojik ilaçlar yer alır. Teratojenik aktivite ile ilaç moleküllerinin kimyasal yapısı arasındaki ilişkiyi inceleyen çalışmalar mevcuttur; Mikroorganizmalarda, ilaca dirençli mutant formların yaygın olarak ortaya çıkmasına benzer bir fenomen gözlenir. Gribin en yoğun olduğu dönemde virüs vücutta çoğaldığında hastalar sentetik kimyasal bileşiklerden oluşan ilaçlar alırlar.
Antiviral ajanların ancak nükleik asitlerin sentezini seçici olarak baskılayabildikleri, yani genetik aparatla doğrudan temasa geçtikleri takdirde oldukça etkili olduğu bilinmektedir. Görünüşe göre, grip virüsü genomunun özellikleri nedeniyle, kimyasal bileşiklerin saf antiviral ve mutajenik etkileri arasındaki çizgi kolaylıkla aşılabilmektedir.
AO serotipine ait influenza virüslerinin antijenik özgüllüğü üzerinde kimyasal bileşiklerin etkisini inceleyen deneylerimiz, süpermutajen sınıfından bazı bileşiklerin, homolog serotipin ötesine geçmeyen değişikliklere neden olabileceğini gösterdi. Özellikle nitrosoalkil ürelerin ilk iki temsilcisi bu özellik için mutasyonlara neden olmuştur (Chulanova, 1968; Akhmatullina ve diğerleri 1974). Ap katsayısını belirlemeyi ve buna dayanarak vahşi ve mutant virüslerin antijenik spesifikliğindeki farkın derecesini belirlemeyi mümkün kılan, önerdiğimiz RZGA modifikasyonunu kullandık.
Çok sayıda kimyasal bileşikle yapılan deneyler, bunların arasında başka bir ajanın daha olduğunu ortaya çıkardı: antijen spesifikliğine dayalı mutasyonda aktif olan 1,4-bis-diazoasetilbutan. İmmunpress yöntemini de kullandık; mutajene maruz kaldıktan sonra virüs, homolog serum varlığında pasajlandı. Değiştirilmemiş viral parçacıklar tamamlayıcı antikorlarla nötrleştirildi ve indüklenen mutantlar için seçici koşullar yaratıldı. Ortaya çıkan antijenik mutantlar, serumla vahşi ve mutant virüslere karşı bir çapraz reaksiyon testinde ve bir çökeltme reaksiyonunda incelendi ve önemli antijenik değişimlere işaret etti.
Bu nedenle, geniş bir dizi kimyasal bileşik kullanılarak indüklenen mutantların daha ileri deneysel çalışmaları, incelenen problem hakkında bilgi sağlayacaktır.
Nezle. Tedavi ve önleme.
Grip, üst solunum yollarının akut bulaşıcı bir hastalığıdır. Kendi başına tehlikeli olan grip, diğer kronik hastalıkların seyrini ağırlaştırır ve kardiyovasküler ve merkezi sinir sistemlerinde, sindirim organlarında, böbreklerde vb. ciddi komplikasyonlara neden olur. Grip en çok çocuklar ve yaşlılar için tehlikelidir. İnfluenzanın yayılma hızı, hastalığın ciddiyeti, komplikasyonların sıklığı ve bazen ölüm - bunların hepsi onun önlenmesini özellikle önemli kılmaktadır. Spor ve jimnastikle uğraşan kişilerin grip virüsüne maruz kalma olasılığı çok daha azdır. Bilinen çeşitli grip virüsü türleri vardır - A, B, C, vb.; çevresel faktörlerin etkisi altında sayıları artabilir. İnfluenzaya karşı bağışıklığın kısa süreli ve spesifik olması nedeniyle bir sezonda tekrarlayan hastalık mümkündür. İstatistiklere göre her yıl nüfusun ortalama %20-35'i gripten etkileniyor.
Enfeksiyonun kaynağı hasta bir kişidir; Virüsün hafif formuna sahip hastalar, kendilerini zamanında izole etmedikleri için virüsün yayıcıları olarak en tehlikeli olanlardır; işe giderler, toplu taşıma araçlarını kullanırlar ve eğlence yerlerini ziyaret ederler.
Enfeksiyon hastadan sağlıklıya konuşma, hapşırma, öksürme veya ev eşyaları yoluyla havadaki damlacıklar yoluyla bulaşır.
İnfluenzanın latent dönemi 1 – 12 saatten 3 güne kadar sürer. Hastalık akut bir şekilde başlar: sıcaklıkta 38-400'e keskin bir artış, titreme, baş ağrısı, kemiklerde ve kaslarda ağrı, genel halsizlik; ağrı ve boğaz ağrısı, tat ve koku bozuklukları ortaya çıkar; 12-24 saat sonra burun akıntısı ortaya çıkar.
Sıcaklık 1-3 gün sürer, bazen 6-7 güne kadar çıkar. Kural olarak, ilk haftanın sonunda sıcaklık normale döner. Uygun tedavi ve bakım ile iyileşme 7-9 gün içinde gerçekleşir.
Gripten şüpheleniliyorsa hasta izole edilmeli ve yatağa yatırılmalıdır. Bu, doktor gelmeden önce yapılmalıdır. İnfluenza patojenlerinin dış ortamda çok kararsız olduğu ve oksijen ve dezenfektanların etkisi altında kolayca yok edildiği göz önüne alındığında odanın düzenli olarak havalandırılması gerekir. Günde en az bir kez çamaşır suyu, formaldehit, soda, kloramin ve çamaşır sabunu kullanarak odayı ıslak temizleyin.
Hastanın bireysel yemekleri olmalıdır. Hastanın sofra takımları ve çay takımları kaynar su ve kabartma tozu ile yıkanmalı veya %5'lik kloramin solüsyonu ile muamele edilmelidir. Hastanın iç çamaşırının ve yatak çarşaflarının sabunlu solüsyonda kaynatılarak sistematik dezenfeksiyonu zorunludur.
Doktor tarafından reçete edilen tüm ilaçlar özel olarak belirlenmiş bir yerde saklanmalıdır. İlaçların yanı sıra hastalığın her döneminde bol miktarda sıvı içilmesi tavsiye edilir: ballı veya limonlu çay, kızılcık suyu, ılık süt, meyve ve sebze suları. Yiyeceklerin kalorisi yüksek olmalıdır. Doktorun talimatlarına kesinlikle uyulmalıdır. Kendi kendine ilaç tedavisi kabul edilemez. İlaçlar doktor reçetesi olmadan alınamaz. Antibiyotiklere ve sülfonamidlere özellikle dikkat edilmelidir - bunlar grip virüsü üzerinde etkili değildir ve izinsiz ve yanlış dozlarda alınırsa alerjik reaksiyonlara neden olabilirler. Ancak ağrısız olarak kullanabileceğiniz şeyler ayak banyoları, hardal sıvaları, soğan, sarımsaktır. Akciğerler yoluyla salınan soğan ve sarımsakta bulunan esansiyel yağlar, mukus salgısını arttırır ve böylece solunum yolu hastalıklarında balgam söktürmeyi kolaylaştırır.
Sağlık hizmetlerinde ayrıca, öncelikle canlı bir aşı ve koruyucu proteinler içeren özel bir serum içeren bir dizi spesifik anti-influenza ajanı da bulunmaktadır. Uygulamaya giren ilaçlar interferon ve oksolinik merhemdir.
Sertleşme, dengeli beslenme, temiz hava ve kronik hastalıkların zamanında tedavisi, başta grip olmak üzere soğuk algınlığını önlemenize yardımcı olacaktır.
Virüslerin (Lat. virüs- zehir) - beladan başka bir şey getirmeyen kötü bir şey. Ancak bu ciddi bir hatadır. Virüsler, canlı doğanın temel yaratıcıları ve onun evriminin motorlarıdır.
Virüslerin hücrelerden "kaçtığı" hipotezine karşı çıkan ana argümanlardan biri, viral genetik sistemlerin hücresel olanlardan çok daha çeşitli olduğu gerçeğidir. Bilindiği gibi hücresel organizmalar yalnızca çift sarmallı (doğrusal veya dairesel) DNA genomlarına sahiptir. Ve virüsün genomu, hem tek hem de çift sarmallı RNA veya DNA molekülleri ile doğrusal veya dairesel olarak temsil edilebilir. Ters transkripsiyon kullanan sistemler de vardır. Böylece retrovirüslerde (örneğin bazı onkovirüsler, HIV) ve pararetrovirüslerde (hepatit B virüsleri, karnabahar mozaiği vb.), genomik DNA zincirlerinden biri bir RNA şablonu üzerinde sentezlenir. Virüsler, hücresel organizmaların aksine, genetik bilgiyi saklamanın ve ifade etmenin teorik olarak mümkün olan tüm yollarını uygular.
Virüslerin hücrelerden kaynaklandığının düşünülmesine karşı olan ikinci önemli argüman, hücresel organizmalarda bulunmayan birçok viral genin bulunmasıdır. Hücresel organizmalar yalnızca virüslerden evrimleşmekle kalmadı, aynı zamanda genetik materyallerinin önemli bir bölümünü virüslerden miras aldılar (ve almaya da devam ediyorlar). Bu bağlamda özellikle ilgi çekici olan endojen virüslerdir (RNA genomunun parçaları veya bir hücrenin genomuna entegre edilmiş DNA virüsleri), bunların arasında retrovirüslerden türetilen genler baskındır. Memelilerin genomlarının yarısından fazlasını virüslerden ve onların en yakın akrabalarından, örneğin plazmitler ve transpozonlar gibi "bencil" genetik unsurlardan miras aldıklarına inanılıyor. Dolayısıyla virüsler insanların ortak ebeveynleridir. Çoğu zaman, insan genomunda çok sayıda bulunan endojen virüslerin gen dizileri değişir ve artık proteinleri kodlamaz. Spesifik biyolojik işlevleri çoğunlukla bilinmese de, bu tür dizilerin hücresel genlerin düzenlenmesinde rol oynadığına inanmak için iyi nedenler vardır. Ancak önemli bir şey biliyoruz: Örneğin, bir endojen retrovirüsün zarf geni tarafından kodlanan protein sinsitin, plasentanın oluşumu sırasında hücre füzyonu için gereklidir. Bu, ne insanların ne de plasentalı hayvanların bu endojen virüs olmadan doğamayacağı anlamına gelir. Önemli bir örnek daha var. Endojen virüslerden birinin genomunun bir bileşeninin, merkezi sinir sisteminin bazı bölgelerinde prolin dehidrojenaz ekspresyonunu kontrol ettiği ortaya çıktı. Bu enzim insan beyninin evriminde önemli bir rol oynamış olabilir. Mutasyonlar sonucu bu enzimin ekspresyonu bozulursa şizofreni dahil ruhsal hastalıklar ortaya çıkar. Virüsler ve akrabaları, hücresel genlerin bir organizmadan diğerine yatay transferinde de önemli bir rol oynar.
Bununla birlikte, evrimdeki kilit rollerine rağmen virüsler en çok insan, hayvan ve bitkilerin patojenleri olarak bilinir (bu arada, ilk keşfedilmelerinin nedeni de budur). Ve sonra viral patojenitenin doğası hakkında konuşacağız. Virüslerin (özellikle ökaryotik virüslerin) konakçıya zarar vermek, hatta onu öldürmek konusunda özel bir “arzusu” yoktur. Ve çoğu durumda virüsler, hücrelerle oldukça barış içinde ve dostane bir şekilde bir arada bulunur. Neden bu kadar çok virüs bu kadar zararlı? Genel açıklama, enfekte olmuş bir hücrenin patolojisinin, virüsün kendi üreme ihtiyaçlarına yönlendirdiği kaynaklarının (maddi ve yapısal) “yağmalanmasından” kaynaklandığıdır. Bununla birlikte, en büyük zarar, konakçıların tedbirsiz koruyucu eylemlerinden ve virüslerin üremeleriyle doğrudan ilgili olmayan koruyucu aktivitesinden kaynaklanabilir.
Koruma ve karşı savunma mekanizmaları
Enfekte bir hücrenin ana savunma mekanizmaları nelerdir? Bunlar doğuştan gelen bağışıklığın bileşenleridir: RNA'nın bozulması (hem viral hem de hücresel), protein sentezinin inhibisyonu (hem viral hem de hücresel), kendi kendini yok etme (apoptoz ve diğer programlanmış ölüm türleri) ve son olarak iltihaplanma. Aslında birçok virüs, neden oldukları iltihaplanma (ensefalit, zatürre vb.) nedeniyle varlığını bu şekilde keşfetti. Hücre, kendi metabolizmasını ve/veya yapısını bozarak virüsle savaşır ve savunma mekanizmaları genellikle kendine zarar verir. Çocuk felcinden ölen bir kişinin (%1'den azı) enfeksiyonla savaşırken kendini öldürdüğünü söyleyebilirsiniz.
Hücresel savunmaya yanıt olarak virüsler evrim geçirerek savunma geliştirirler ve virüs ile hücre arasında bir silahlanma yarışı yaşanır. Bu ilaçlar öncelikle hücrenin savunma reaksiyonlarının altında yatan genel metabolik süreçlere yöneliktir. Bu da yine hücresel RNA ve proteinlerin sentezinin inhibisyonu, hücre içi altyapının ve hücre taşınmasının bozulması, baskılanması veya tersine apoptozun ve programlanmış hücre ölümüne neden olan diğer mekanizmaların başlatılmasıdır. Dolayısıyla bir virüsün savunma stratejisi birçok açıdan hücrenin savunma davranışına benzer. Mecazi anlamda konuşursak, güreşçiler aynı teknikleri kullanır ve aynı hedeflere ulaşırlar. Örneğin viral proteinlerin sentezini baskılayan bir hücre interferon kullanır ve oluşumunu engellemek için virüs de hücredeki protein sentezini engeller. Koşullara göre bir taraf ya da diğer taraf fayda sağlar. Patolojiye asıl katkının virüsün bu şekilde çoğalması değil, hücresel savunma ile viral savunma arasındaki çatışma olduğu ortaya çıktı. Bitki patolojisinde "tolerans" kavramı uzun zamandır mevcuttur: patojenik bir virüs, enfekte olmuş bir bitkide ağrılı semptomlara neden olmadan aktif olarak çoğalabilir.
Aşağıda esas olarak RNA virüslerinden bahsedeceğiz (bu daha basit bir örnektir). Bir RNA virüsü hücreye girdiğinde varlığını nasıl ortaya çıkarır? Peki hücre, içine virüs girdiğini nasıl biliyor? Hücrenin bunu "anladığı" ana özellik, prensip olarak enfekte olmamış bir hücrede oluşabilen, ancak bu miktarlarda ve yerlerde oluşturulamayan viral çift sarmallı RNA'dır. Bazı durumlarda hücre, viral tek sarmallı RNA'yı ve bazen (çok daha az sıklıkla) viral proteinleri de tanır. Viral RNA'nın tanınmasının spesifik olmaması önemlidir: çift sarmallı RNA'yı "algılayan" hücre, kendisine bir virüsün girdiğini "düşünebilir", ancak hangisinin olduğunu bilmez. RNA iki tür sensör tarafından yakalanır: ücretli benzeri (İngilizce'den. ücretli benzeri ve ondan. Geçiş ücreti- dikkate değer) reseptörler ve özel RNA helikazları. Bunlar, interferon oluşumu da dahil olmak üzere, transkripsiyonel düzeyde bir dizi koruyucu mekanizmayı içerir. Ek olarak viral RNA'lar, bazı çeviri başlatma faktörlerini fosforile eden ve böylece protein sentezini inhibe eden çift sarmallı RNA'ya bağımlı protein kinaz PKR olan "yürütücüler" tarafından tanınır; RNA'yı parçalayan RNase L'yi aktive eden oligoadenilat sentetaz (OAS); RNA müdahale sistemi, RNA bozulmasına ve çevirisinin bozulmasına yol açar.
Virüs spesifik olmayan bir şey olarak tanındığı için hücre "niyetini" bilemez. Ve genel olarak olası herhangi bir virüse karşı bireysel bir doğuştan savunma sistemi oluşturmak imkansızdır. Bu, hücrenin virüsle ancak standart tekniklerle savaşabileceği anlamına gelir. Bu nedenle savunma eylemleri çoğu zaman mevcut tehditle orantısızdır. Ancak hücrenin savunma tepkileri bu kadar spesifik değilse neden farklı virüsler hala farklı hastalıklara neden oluyor? İlk olarak, her virüs belirli bir organizmada yalnızca belirli bir hücre tipini enfekte edebilir. Bunun nedeni, hücreye nüfuz edebilmek için kendisine "uygun" olan hücresel reseptörlerle etkileşime girmesi gerektiğidir. Ek olarak, virüslerin çoğalması için belirli bir hücre içi ortam gereklidir (genellikle belirli hücresel proteinlere ihtiyaç vardır). İkincisi, hücrenin savunma reaksiyonları standart olsa da, virüsün savunması standart hücresel mekanizmalara yönelik olsa da büyük ölçüde bireyseldir.
Bitkilerde RNA müdahalesi antiviral bir mekanizma olarak çok önemli bir rol oynar. Çift sarmallı RNA, viral RNA'dan oluşur (hücrenin bir virüsün varlığını öğrenmesini sağlayan önemli bir faktör). RNA girişim sisteminin bileşenlerinin (bu çift sarmallı RNA'yı 21-25 nükleotid çifti uzunluğunda parçalara bölen Dicer enzimi ve ardından RNA-protein kompleksi RISC) katılımıyla, sonunda tek sarmallı kısa RNA parçaları oluşur. oluşturulan. Viral RNA ile melezleşerek ya bozulmasına ya da çevirisinin engellenmesine neden olurlar. Bu koruyucu mekanizma etkilidir ancak viroid örneğinde açıkça görüldüğü gibi hücrenin kendisine zarar verebilir. Bunlar bitki patojenleridir, kısa (birkaç yüz nükleotid) dairesel tek sarmallı RNA molekülleridir ve bir protein kabuğuyla kaplanmamıştır. Viroidler proteinleri kodlamaz ancak enfekte olmuş bir bitkide ciddi semptomlara neden olabilir. Bunun nedeni hücrenin kendisini korumasıdır. Ortaya çıkan viroid çift sarmallı RNA, RNA girişim sisteminin tüm bileşenlerine maruz kalır, bu da viral RNA ile değil hücresel RNA ile hibridize olan tek sarmallı RNA fragmanlarının oluşmasıyla sonuçlanır. Bu, bozulmasına ve hastalık semptomlarının gelişmesine yol açar. Bununla birlikte birçok bitki virüsü, RNA müdahalesine müdahale eden çeşitli proteinleri kodlar. RNA susturmanın viral baskılayıcıları - VSR). Ya viral RNA'ların tanınmasını ve bölünmesini engellerler ya da RISC kompleksinin oluşumunu ve işleyişini baskılarlar. Bu nedenle, bu VSR proteinleri fizyolojik olarak önemli (viral olmayan) RNA müdahale mekanizmalarını bozarak patolojik semptomlara neden olabilir.
Güvenlik proteinleri
Virüslerin, özellikle de küçük RNA içeren patojenler olan picornavirüslerin savunması, büyük ölçüde bu tür proteinlerin çalışmasına bağlıdır. Bu büyük grup, özellikle çocuk felci, hepatit A, şap hastalığı vb. patojenlerini içerir. Bu virüslerin özelliği, nadir istisnalar dışında, proteinlerinin tek bir poliprotein formunda sentezlenmesidir. daha sonra hangi bireysel olgun proteinler oluşturulur. Bunlar arasında üç grup ayırt edilebilir. Birincisi, hayati öneme sahip, sabit işlevlere sahip, virüsün çoğalmasını doğrudan sağlayan anahtar proteinlerden oluşur: viral genomun replikasyonu için gerekli olan RNA'ya bağımlı RNA polimerazları; virüsün protein kabuğunu oluşturan kapsid proteinleri; poliproteinleri olgun proteinlere dönüştürme sürecinde yer alan proteazlar; VPg proteini ( viral protein genomu bağlantılı- RNA moleküllerinin sentezi için bir primer görevi gören genoma bağlı bir viral protein; Helikaz, tüm pikornavirüslerin sahip olduğu çok değerli bir enzimdir ancak rolü çok açık değildir. İkinci grup aynı zamanda hayati proteinleri de içerir, ancak "yardımcı" iş yapanlar - hidrofobik "kılavuz" proteinler 2B ve 3A. Anahtar proteinleri hedeflerine yönlendirirler ve virüsün çoğalması için optimal hücre içi ortamın yaratılmasına yardımcı olurlar. Üçüncü grupta ise 30 yıl önce laboratuvarımızda keşfedilen lider protein L ve protein 2A; onlara “güvenlik” proteinleri adını verdik ( güvenlik- güvenlik). Bu, picornavirüslerin özel bir anti-savunma “silahıdır”. Genel olarak bu protein sınıflarının üçü de hücrenin savunma mekanizmalarıyla savaşabilir. Ancak anahtar proteinler ve kılavuz proteinler bu işi yarı zamanlı olarak yaparlar çünkü yapılarının ve işlevlerinin uyması gereken başka önemli sorumlulukları vardır. Sonuç olarak, savunma yetenekleri, temel işleri yapma ihtiyacı nedeniyle sınırlıdır. Ancak "güvenlik" sincapları uzmanlık alanlarında tam zamanlı çalışırlar - evrim onları özellikle "güvenlik" için "işe aldı" (daha sonra bazıları başka bir şey yapmayı "öğrendi"). Görevlerini yerine getirmek için gerekli her türlü yapıya sahip olabilirler.
Güvenlik proteinlerinin en önemli işlevlerinden biri, enfekte olmuş bir hücrenin kaderinin belirlenmesinde görev almalarıdır. Ölümü için pek çok farklı seçenek vardır, ancak en iyi bilinen iki ana mekanizma, morfolojik ve biyokimyasal özellikler açısından farklılık gösteren nekroz ve apoptozdur. Nekroz sırasında hücre parçalanır ve içeriği hücreler arası boşluğa dökülür. Apoptoz sırasında yüzeyinde açıkça görülebilen çıkıntılar oluşur, DNA'sı nükleozomal parçalara ayrılır ve sonuçta hücre, plazma zarıyla sınırlı olan bireysel apoptotik cisimciklere bölünür. Hücrenin tam olarak nasıl öldüğü çok önemlidir. Nekrozla birlikte koruyucu inflamasyon gelişir ancak virüs hücreyi terk ederek yayılır. Apoptozda virüsün yayılımı sınırlıdır ve genellikle herhangi bir inflamatuar reaksiyon görülmez. Enfekte bir hücrenin ölümü, kural olarak, virüsün çoğalmasını sınırlayan bir fedakarlık eylemidir.
Picornavirüslerle enfeksiyonun, özellikle de çocuk felci virüsünün (poliovirüs) hücre apoptotik programını tetiklediğini bulduk. Bu, sitokrom mitokondriden salındığında klasik yollardan biri boyunca meydana gelir. C ve bir dizi proteolitik enzim olan kaspazlar aktive edilir. Ancak öte yandan virüslerin anti-apoptotik bir mekanizmaya, yani hücrenin apoptotik reaksiyonunu baskılama yeteneğine sahip olduğu ortaya çıktı. Böylece, çocuk felci virüsü veya ensefalomiyokardit virüsü (aynı zamanda pikornavirüs) ile enfekte olan HeLa hücreleri, nekroz belirtileriyle ölür. Ancak anti-apoptotik “silahı” kapatırsanız (viral proteinlerin sentezini bastırırsanız), hücre apoptozdan (fedakarlık) ölür. Her iki virüste de “güvenlik” proteinleri bu tür silah görevi görüyor. Bununla birlikte, ensefalomiyokardit virüsünde bu rol L proteini tarafından oynanır ve çocuk felci virüsünde 2A proteinidir. Lider proteinin enzimatik aktivitesi yoktur, 2A proteini ise bir proteazdır. Yapısal veya biyokimyasal olarak hiçbir ortak noktaları yoktur ancak her ikisinin de farklı moleküler mekanizmalara dayalı antiapoptotik etkileri vardır.

Picornavirüs güvenlik proteinlerinin bir başka anti-koruyucu mekanizması nükleer sitoplazmik taşınmanın bozulmasıdır [10-12]. Bu virüslerle enfekte olduğunda nükleer membranın geçirgenliğinin arttığını ve sitoplazma ile çekirdek arasındaki aktif makromolekül alışverişinin bozulduğunu gösterdik. Hücre yapısı hasar görürse virüsle savaşmak için düzenleyici mekanizmalarını çalıştıramaz. Çocuk felci virüsünde güvenlik proteini 2A, nükleer gözeneklerin bileşenleri olan nükleoporinleri hidrolize ederek nükleer sitoplazmik taşınmayı bozar. Ve ensefalomiyokardit virüsünün lider proteini çalışır - nükleoporinlerin [,] hücresel fosforilasyon kademesini etkiler.
“Güvenlik” proteinlerinin anti-koruyucu işlevi başka şekillerde de kendini gösterebilir. Böylece, kardiyovirüslerin L proteinleri (ensefalomiyokardit virüsü dahil) ve enterovirüslerin 2A proteinleri (çocuk felci virüsü dahil) interferon oluşumunu engeller. Ve etkisi şap hastalığı virüsünün L-proteini ve çocuk felci virüsünün 2A proteini tarafından engellenir. Ancak pikornavirüslerin “güvenlik” proteinleri hayati öneme sahip değildir. Her iki koruyucu da çıkarılabilir veya virüs yaşayabilir hale getirilmeden bunlarda büyük silinmeler meydana gelebilir (kardiyovirüslerin L proteini, hepatit A virüsünün 2A proteinleri ve kardiyovirüslerde olduğu gibi).
Karşılıklı silahsızlanma

Viral “güvenlik” proteinlerinin hücre için etkisiz hale getirilmesinin sonuçları ne olacaktır? Bir yandan virüslerin doğuştan hücresel bağışıklığın koruyucu mekanizmalarına duyarlılığı artacak. Ancak diğer yandan kendine zarar verme, intihar eğilimi de artacaktır. Hücrenin ve virüsün savunma mekanizmalarını aynı anda kapatırsanız ne olur? Bu durumu mengovirüs (ensefalomiyokardit virüsünün bir türü) ile HeLa hücreleri arasındaki etkileşim örneğini kullanarak inceledik. Vahşi tip bir virüsle enfekte olduklarında nekroz nedeniyle hızla ölürler. Ve eğer virüs kısmen etkisiz hale getirilirse (lider protein etkisiz hale getirilirse), HeLa hücreleri biraz daha uzun yaşar ve nekrozdan değil apoptozdan ölür. Karşılıklı savunma azaldığında (apoptoz, kaspazları engelleyen kimyasal bir bileşik tarafından hücrede kapatılır ve virüsün lider proteini etkisiz hale getirilir), iki kat daha uzun bir sürenin ardından bile hücreler, kendilerini hissetmeyenlere göre önemli ölçüde daha iyi hissederler. silahsız. Ve virüsün çoğalması (hem dinamik hem de hasat), yalnızca savunmasının mı kapatıldığına ya da aynı anda hücresel savunmanın da kaldırılıp kaldırılmadığına bakılmaksızın, tamamen aynı şekilde ilerledi. Henüz ciddi patolojik hasara (sözde sitopatik etki) sahip olmayan hücrelerde, birçok viral partikülün zaten oluşabileceği ortaya çıktı. Bu nedenle virüsün çoğalması için hücre hasarına gerek yoktur. Bu nedenle hastalığın semptomlarını hafifletmeyi amaçlayan antiviral tedavi için etkili bir strateji, hem viral hem de hücresel savunmanın eşzamanlı olarak baskılanması olabilir.
Programlanmış ölüm
Bu deney serimiz aynı zamanda virüsün neden olduğu nekrotik ölümün doğasına daha derinlemesine nüfuz etme fırsatı da sağladı. Nedir bu - bir hücrenin bir virüs tarafından öldürülmesi mi yoksa onun intiharı mı (kendini feda etmesi), ortak iyilik uğruna ölmenin daha uygun olduğuna karar vermesi mi? Aşağıdakiler nekrotik lezyonlara tabidir:
- plazma zarı (geçirgenliği artar, “kabarcıklar” oluşur),
- sitoplazma (mikrotübüller ve mikrofilamentler değişir),
- çekirdek (küçülür, deforme olur, kromatin yoğunlaşır),
- metabolik aktivite (NADH'ye bağlı redüksiyon reaksiyonları, canlılık değişimi).
Apoptoz kapatıldığında (bir kimyasal kaspaz inhibitörünün eklenmesi), çeşitli nekrotik değişiklikler viral lider proteinin çalışıp çalışmamasına bağlıdır. Örneğin, eğer inaktive edilirse, hücrenin membran geçirgenliği değişmez, ozmotik dengedeki dengesizliğe bağlı “kabarcıklar” ortaya çıkmaz ve bir dizi başka nekrotik lezyon meydana gelmez. Bu etkinin olası bir açıklaması, L proteininin farklı hücresel bölümlerdeki birden fazla hedefe etki etmesidir. Ancak protein küçük olduğundan ve enzimatik aktiviteye sahip olmadığından doğrudan hedeflerinin çok daha küçük olması muhtemeldir. Lider proteinin, hücrenin kaderini kontrol eden bir veya daha fazla anahtar hücresel element üzerinde etki ettiğini ve bunun sonucunda, listelenen patolojik değişikliklerin çoğundan sorumlu olan nekrotik programının başlatıldığını varsayıyoruz. Sonuç olarak hücreyi nekrotik olarak öldüren virüs değil, hücrenin kendisi intihar eder (fedakarlık yapar). Bu bakış açısı, apoptoza ek olarak, nekroza benzer nekroptoz da dahil olmak üzere, programlanmış (hücresel genomda kodlanmış) hücre ölümünün bir dizi fizyolojik olarak önemli başka türlerinin bulunduğu yeni fikirlerle tutarlıdır.
Bu nedenle viral enfeksiyon sırasında hücrenin kendini feda etmesi nekroptoz veya apoptoz olarak kendini gösterebilir. Nekroptoz, bir hücrenin viral bir enfeksiyona karşı koruyucu bir reaksiyonu olabilir ve yalnızca pikornavirüslerde değil. Hangi mekanizmanın virüs açısından daha faydalı olduğu koşullara bağlıdır. Anti-koruyucu etkisinin, hücre genomunda kodlanan mekanizmaların “yeniden yönlendirilmesi” şeklinde kendini gösterebildiğini görüyoruz. Bu önemli (tek olmasa da) bir savunma yöntemidir ve virüslerin patojenitesinin ana mekanizmalarından biridir. Virüs kaynaklı apoptoz ve nekroz programları birbiriyle rekabet halindedir. HeLa hücrelerine çocuk felci virüsü bulaştığında, önce apoptozun aktive olduğunu, ardından baskılandığını ve nekrotik yolun başlatıldığını gösterdik. Böylece, bir hücrenin virüsle enfeksiyonu, içinde programlanmış ölümün iki intihar mekanizmasının (apoptotik ve nekrotik) bulunduğu bir dizi koruyucu eylemi harekete geçirir. Ve sonra bu yollar arasında rekabet ortaya çıkar: Birinin bastırılması diğerini harekete geçirir ve bunun tersi de geçerlidir. Ve tüm bunlar hücresel proteinler, viral proteinler (öncelikle "güvenlik" proteinleri) ve dış faktörler tarafından düzenlenir.
Silâhlanma yarışı
Hücrelerin savunma mekanizmaları olduğu ve virüslerin de savunma mekanizmaları olduğu için doğal olarak aralarında bir silahlanma yarışı da oluyor. Güvenlik proteinlerinin muhafazakar olmayan doğası, bunların belirli bir konağın savunma mekanizmalarına karşı koymak üzere uyarlandıklarını göstermektedir. Dolayısıyla bu değişime "güvenlik" protein fonksiyonunun kaybı ve bunun sonucunda da konağın savunma tepkilerinde artış eşlik edebilir. Bu, “yeni”nin özel patojenitesini açıklayabilir ( yeni ortaya çıkan- ortaya çıkan) virüsler. Bu nedenle influenza virüsü, yabani kuşların düşük patojenik, neredeyse zararsız bir bağırsak virüsüdür. Bir kişiye bulaştığında İspanyol gribi, kuş gribi veya domuz gribi ortaya çıkabiliyor. SARS virüsü yarasalar için nispeten güvenli, ancak insanlarda yüksek mortalitenin eşlik ettiği ciddi akut solunum sendromuna neden oluyor. Son olarak HIV (daha doğrusu atası) maymunlar için pratik olarak zararsızdır, ancak insanlarda AIDS'e neden olur. Bu virüslerin yeni bir konakçıya geçerken yeni patojenite faktörleri geliştirmemeleri (basitçe hücreye nüfuz etmeyi sağlayan çeşitli mutasyonlar sonucunda insanlara bulaşma yeteneği kazanmaları) çok önemlidir. Virüs ile konakçı arasındaki dengesizliğin ve yeni patojenlerin ortaya çıkmasının bir başka olası mekanizması da viral savunma silahlarında bir değişiklik olabilir; örneğin eskisinin kaybı veya yeni bir "güvenlik" proteininin kazanılması.
Bununla birlikte, konakçının ve virüsün uzun vadeli birlikte evrimi, ikincisinin patojenitesinde bir azalmaya yol açmalıdır (karşılıklı yarar sağlayan silahsızlanma). Klasik örnek miksoma/fibroma virüsüdür. 19. yüzyılın ortalarında. Avrupa tavşanları Avustralya'ya getirildi, hızla çoğaldılar ve tarım için ciddi bir tehdit haline geldiler. 100 yıl sonra patojenik fibroma/miksoma virüsü (çiçek virüsünü de içeren çiçek virüsü ailesinden) popülasyonlarını kontrol etmek için kullanılmaya başlandı. Farklı tavşanlar bu virüse farklı tepki verir. Brezilya tavşanlarında, enfeksiyondan üç hafta sonra, iyi huylu bir tümöre - fibroma (ciltte lokalize nodül) neden olur. Ancak bu virüse duyarlı Avrupa tavşanlarında enfeksiyondan sonraki 10 gün içinde genelleştirilmiş ölümcül bir hastalık gelişir.
Avustralya'ya tanıtılan virüs, sivrisinek kaynaklı yaz salgınlarına neden oldu ve enfekte tavşanların %99'undan fazlası iki haftadan kısa bir sürede öldü. Virüsün daha az öldürücü varyantlarının kışın hayatta kalma olasılığı daha yüksekti ve bu da zayıflatılmış (zayıflamış) türlerin seçilmesine yol açtı. Ve yaklaşık 10 yıl sonra, Avrupa tavşanlarının gelişen virüsten ölüm oranı yarı yarıya azaldı. Aynı zamanda dirençli tavşanlar seçildi: Orijinal virüsten ölüm oranları yaklaşık dört kat azaldı. Sadece on yıl içinde (evrimsel açıdan ihmal edilebilir bir dönem), patojen ile konakçı arasındaki ilişki yaklaşık 10 kat gelişti. Bu elbette biraz basitleştirilmiş bir plan çünkü silahlanma yarışı durmuyor: tavşanlarda artan dirence yanıt olarak virüsün virülansı da artabilir. Ancak bu, virüslerin ve hücresel organizmaların etkileşiminin her ikisinin de evrimindeki rolünün çarpıcı bir örneğidir. Virüsler ve hücreler birbirlerine “öğretir” ve edinilen “bilgi” miras alınır. 2013 yılında Moskova Devlet Üniversitesi Viroloji Bölümü mezunu Evgeny Kunin ve Valeryan Dolya, virüslerin ve hücresel organizmaların direncinin ve işbirliğinin ana faktör olduğunu öne süren "virosentrik" evrim görüşü hakkında bir makale yayınladılar. onların evrimi.
Hikayem konuyu özetlemiyor: Virüslerin patojenitesinin doğası hakkında çok daha fazla şey biliniyor. Şu anda bildiklerimizin çoğu son yıllarda öğrenildi ve yeni sürprizler beklemek için her türlü neden var. Ciddi hastalıklar için virüsleri suçlayabiliriz ve suçlamalıyız ve onlarla savaşmak gerekir, ancak insanların varlığı da dahil olmak üzere canlı doğanın varlığı ve çeşitliliği için virüslere minnettar olmalıyız.
Yazar, bilimsel işbirliğindeki meslektaşlarına - adını taşıyan Çocuk Felci ve Viral Ensefalit Enstitüsü personeline - minnettardır. M. P. Chumakov RAMS, Moskova Devlet Üniversitesi. M.V. Lomonosov, Protein RAS Enstitüsü (Pushchino, Moskova Bölgesi), Basel Üniversitesi (İsviçre), Wisconsin Üniversitesi (ABD), Nijmegen Üniversitesi. Radboda (Hollanda).
Makale, “Modern biyoloji ve geleceğin biyoteknolojileri” okulunda verilen bir derse dayanmaktadır (Zvenigorod, 26 Ocak - 1 Şubat 2014).
. Belov G.A., Lidsky P.V., Mikitas O.V. ve diğerleri. Çocuk felci virüsü enfeksiyonu ve buna eşlik eden nükleer gözeneklerdeki değişiklikler üzerine nükleer zarfın geçirgenliğinde çift yönlü artış // J. Virol. 2004. V. 78. S. 10166–10177. doi:10.1128/JVI.78.18.10166-10177.2004. Lidsky P.V., Hato S., Bardina M.V. ve diğerleri. Kardiyovirüslerin neden olduğu nükleositoplazmik trafik bozukluğu // J. Virol. 2006. V. 80. S. 2705–2717. doi:10.1128/JVI.80.6.2705-2717.2006
. Bardina M.V., Lidsky P.V., Sheval E.V. ve diğerleri. Nükleer gözenek kompleksinin Mengovirüs kaynaklı yeniden düzenlenmesi: hücresel fosforilasyon makinesinin kaçırılması // J. Virol. 2009. V. 83. S. 3150–3161. doi:10.1128/JVI.01456-08
. Mikitas O.V., Ivin Y.Y., Golyshev S.A. ve diğerleri. Litik RNA virüsünün (mengovirüs) neden olduğu yaralanmaların bastırılması ve bunların karşılıklı hücre/virüs silahsızlandırılmasıyla viral üremeden ayrılması // J. Virol. 2012. V. 86. S. 5574–5583. doi:10.1128/JVI.07214-11
. Agol V.I., Belov G.A., Bienz K. ve diğerleri. Çocuk felci virüsü ile enfekte olmuş hücrelerde yarışan ölüm programları: bulaşıcı döngünün ortasında taahhüt değişikliği // J. Virol. 2000. V. 74. S. 5534–5541. doi:10.1128/JVI.74.12.5534-5541.2000
. Agol V. I. Sitopatik etkiler: doğuştan gelen bağışıklığın virüs tarafından modüle edilen belirtileri? // Trendler Mikrobiyol. 2012. V. 20. S. 570–576. doi:10.1016/j.tim.2012.09.003
. Koonin E.V., Dolja V.V. Yaşamın evrimine virüs merkezli bir bakış açısı // Curr. Görüş. Virol. 2013. V. 3. S. 546–557. doi:10.1016/j.coviro.2013.06.008