Jaka jest osobliwość natury wirusów? Ogólna charakterystyka wirusów. Patogeneza chorób wirusowych. Charakter wirusów i ich badanie
Na dorocznej konferencji Amerykańskiego Towarzystwa Onkologii Klinicznej, która odbyła się właśnie w San Francisco, ukazał się sensacyjny raport naukowców, którzy odkryli wirusa w tkankach pacjentów z rakiem prostaty, którego wcześniej znajdowano tylko u chorych na raka myszy. A skoro wirus jest znany, znacznie łatwiej jest stworzyć leki przeciwnowotworowe. Nawiasem mówiąc, wirusową teorię raka potwierdził radziecki naukowiec Lew Zilber już w latach czterdziestych XX wieku.
Co więcej, wirusa tego znaleziono tylko w tkankach pacjentów, którzy mają określoną wadę genetyczną.
„Nie twierdzimy, że wirus jest bezpośrednią przyczyną choroby” – powiedział współautor badania, dr Eric Klein z Cleveland Clinic. „Ale to ekscytujące odkrycie wskazuje na zupełnie nowe możliwości badania raka prostaty”.
Naukowcy nie wiedzą jeszcze, w jaki sposób wirus myszy przedostaje się do organizmu człowieka, ale sugerują, że może być on dziedziczony genetycznie. Doktor Klein i jego kolega dr Joe Derisi z Uniwersytetu Kalifornijskiego zastosowali technologię „chipu genetycznego”. Podobną diagnostykę stworzyli rosyjscy naukowcy z Instytutu Biologii Molekularnej Rosyjskiej Akademii Nauk. Na specjalnej płytce Derisi umieścił charakterystyczne fragmenty materiału genetycznego 20 tysięcy znanych wirusów. Klein dostarczył mu 86 próbek tkanek od pacjentów z rakiem prostaty. Pobrano z nich próbki DNA i umieszczono je na chipie. DNA 20 pacjentów, u których wykryto zmutowany gen, pokrywało się z DNA mysiego onkowirusa. Mutacja to duplikacja genu kodującego produkcję enzymów niszczących wirusy atakujące organizm.
Okazało się, że mężczyźni posiadający podwójny gen produkują znacznie mniej tych enzymów. Spośród 66 pacjentów z prawidłowym genem wirusa wykryto tylko u jednego. Naukowcy planują zbadać setki chorych i zdrowych osób, aby wyjaśnić związek między obecnością wirusa a rakiem prostaty.
Odkrycie amerykańskich naukowców staje się kolejnym praktycznym potwierdzeniem wirusogenetycznej teorii raka, sformułowanej przez Lwa Zilbera jeszcze w latach 40. XX wieku.
Teorię pochodzenia raka stworzył Lew Zilber w więzieniu, wyprzedzając o pół wieku świat naukowy
Akademik Lew Kiselev, syn Lwa Zilbera, odpowiada na pytania Izwiestii.
Wiadomo, że Lew Aleksandrowicz stworzył swoją teorię w latach 40. w obozie. Ale hipoteza wirusowa została wyrażona już wcześniej?
Pierwsze hipotezy dotyczące wirusowego charakteru raka zostały sformułowane na początku XX wieku, m.in. przez naszego rodaka Ilję Mechnikowa. Ale Lew Zilber sformułował holistyczną teorię wirusogenetyczną, która znacznie wyprzedziła swoje czasy.
- Ale współcześni nie zaakceptowali nowej teorii?
Tak, przez 20 lat w pojedynkę udowadniał, że miał rację. Dopiero w latach 60. pojawiło się pierwsze eksperymentalne potwierdzenie teorii. Wielkie wsparcie zapewniła praca Czecha Jana Svobody z Instytutu Genetyki Czechosłowacji, który wciąż żyje.
- Dziś nie ma już wątpliwości co do słuszności Lwa Aleksandrowicza?
Obecnie uważa się, że aż 25% wszystkich nowotworów powstaje z udziałem onkowirusów. Zostało to udowodnione w szczególności w przypadku raka wątroby wywoływanego przez wirusy przewlekłego zapalenia wątroby typu B i C oraz raka szyjki macicy (wirus brodawczaka ludzkiego). Istnieją sugestie, że choroby takie jak rak piersi, rak żołądka i niektóre inne powstają nie bez udziału wirusów. Udowodniono również, że wszystkie nowotwory u zwierząt wywoływane są przez wirusy. Słowa mojego ojca „rak jest chorobą genomu” okazały się prorocze, bo w tamtym czasie rozszyfrowanie genomu było niesamowicie odległe.
Wielki naukowiec, bystry człowiek
Lew Zilber urodził się w 1894 roku w Pskowie. Po ukończeniu Wydziału Lekarskiego pracował w Moskwie i Baku, brał udział w zwalczaniu dżumy w ZSRR i opracował teorię kleszczowego zapalenia mózgu, sugerującą, że wirus choroby jest przenoszony przez kleszcze. Dwukrotnie był więziony na podstawie absurdalnych zarzutów (w latach 1937-39 i 1940-44). Jego brat, pisarz Veniamin Kaverin, i jego była żona Zinaida Ermolyeva, znana jako twórczyni „radzieckiej penicyliny”, bezinteresownie walczyli o jego uwolnienie. Wiadomo, że brat był prototypem Sanyi Grigoriewa z ukochanej przez miliony ludzi opowieści Kaverina „Dwóch kapitanów”. Powieść „Otwarta księga” poświęcona jest Ermolyevie.
Zilber swoją teorię pochodzenia raka stworzył w więzieniu, przeprowadzając eksperymenty w naukowej „szaraszce”. Szczury i myszy łapali dla niego więźniowie, którym płacił tytoniem. Badając mechanizmy rozwoju nowotworu, Zilber doszedł do wniosku, że wirus przedostając się do zdrowej komórki zmienia jej podłoże genetyczne, dzięki czemu komórka wychodzi poza kontrolę organizmu i zaczyna się bez przeszkód dzielić – w ten sposób powstaje guz. Lew Aleksandrowicz opublikował pierwszy artykuł na temat swojej teorii w naszej gazecie w 1945 roku. W tym samym roku ukazała się jego monografia na ten temat.
Źródło:
Inne artykuły w Zdrowie:
| 14 grudnia 2016 r |
20 maja 2016 r |
17 maja 2016 r |
| 22 listopada 2015 r |
Wirusy odkrył rosyjski botanik D.I. Iwanowskiego (1864 – 1920) w 1892 r. podczas badań nad chorobą mozaikową liści tytoniu. Termin „wirus” został po raz pierwszy zaproponowany w 1898 r. przez holenderskiego naukowca M. Beijerincka (1851 – 1931).
Obecnie znanych jest około 3000 różnych typów wirusów.
Rozmiary wirusów wahają się od 15 do 350 nm (długość niektórych nitkowatych dochodzi do 3000 nm; 1 nm = 1·10–9 m), tj. większość z nich nie jest widoczna w mikroskopie świetlnym (submikroskopowym), a ich badanie stało się możliwe dopiero po wynalezieniu mikroskopu elektronowego.
W przeciwieństwie do wszystkich innych organizmów, wirusy nie mają struktury komórkowej!
Dojrzała cząstka wirusa (tj. zewnątrzkomórkowa, spoczynkowa – wirion) struktura jest bardzo prosta: składa się z jednej lub większej liczby cząsteczek kwasów nukleinowych, które ją tworzą rdzeń wirus i otoczka białkowa (kapsyd)– są to tzw proste wirusy.
Złożone wirusy(Na przykład, opryszczka Lub grypa) dodatkowo białka kapsydu i kwas nukleinowy zawierają dodatkowe lipoproteina membrana(otoczka, superkapsyd utworzony z błony komórkowej komórki gospodarza), różne węglowodany I enzymy(ryc. 3.1).
Enzymy ułatwiają przenikanie wirusowego NK do komórki i uwalnianie powstałych wirionów do środowiska ( neuraminidaza myksowirusy, ATPaza I lizozym niektóre fagi itp.), a także uczestniczą w procesach transkrypcji i replikacji wirusowego NK (różne transkryptazy I replikaza).
Osłonka białkowa chroni kwas nukleinowy przed różnymi wpływami fizycznymi i chemicznymi, a także zapobiega wnikaniu do niego enzymów komórkowych, zapobiegając w ten sposób jego rozpadowi (funkcja ochronna). Kapsyd zawiera także receptor komplementarny do receptora zakażonej komórki – wirusy infekują ściśle określony zakres żywicieli (funkcja definiująca).
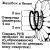
Wiriony ma to wiele wirusów roślinnych i wiele fagów spirala kapsyd, w którym podjednostki białka (kasomery) są ułożone spiralnie wokół osi. Na przykład VTM ( wirus mozaiki tytoniu) ma kształt pręcików o średnicy 15–17 nm i długości do 300 nm (ryc. 3.2.). Wewnątrz jego kapsydu znajduje się pusty kanał o średnicy 4 nm. Materiał genetyczny TMV to Ryż. 3.2.
Struktura wirusa mozaiki tytoniowej. W rowku helikalnego kapsydu znajduje się jednoniciowy RNA ciasno upakowany. Dla wiriony ze spiralnym kapsydem charakteryzuje się wysoką zawartością białka (90 – 98%) w stosunku do
W rowku helikalnego kapsydu znajduje się jednoniciowy RNA ciasno upakowany. Dla wiriony ze spiralnym kapsydem charakteryzuje się wysoką zawartością białka (90 – 98%) w stosunku do
Kapsydy wirionów wielu wirusów (np. adenowirus, wirus opryszczka, żółty wirus mozaiki z rzepy– VZhMT) mają kształt symetrycznego wielościanu, najczęściej dwudziestościanu (wielościan o 12 wierzchołkach, 20 ścianach trójkątnych i 30 krawędziach). Takie kapsydy nazywane są izometryczny(Rys. 3.3.). W takich wirionach zawartość białka wynosi około 50% w stosunku do NK.

Wirus zawsze zawiera jeden rodzaj kwasu nukleinowego (DNA lub RNA), dlatego wszystkie wirusy dzielą się na zawierające DNA i zawierające RNA. Cząsteczki kwasu nukleinowego w wirionie mogą być liniowe (RNA, DNA) lub pierścieniowe (DNA). Co więcej, te kwasy nukleinowe mogą składać się z jednego lub dwóch łańcuchów. Wirusowy NK ma od 3 do 200 genów.
Kwas nukleinowy wirusa łączy w sobie funkcje obu kwasów (DNA i RNA) - przechowywanie i przekazywanie informacji dziedzicznej, a także kontrolę syntezy białek.
W przeciwieństwie do wirusów wszystkie organizmy komórkowe zawierają oba rodzaje kwasów nukleinowych.
Wirusy bakteryjne mają bardziej złożoną strukturę – bakteriofagi(Rys. 3.4.). Składają się z główki i ogona (pręt i osłona, płytka podstawna i włókna procesowe). Długa cząsteczka NA (RNA lub DNA) jest zwinięta w spiralę wewnątrz głowy bakteriofaga (otoczki białkowej).
Wirusy obejmują również wiroidy– czynniki zakaźne będące niskocząsteczkowymi (krótkimi) jednoniciowymi kolistymi RNA, które nie kodują własnych białek (pozbawionych kapsydu). Są przyczyną wielu chorób.
DO

W
Ryż. 3.4.
Budowa bakteriofaga. Wątki procesu
Naukowcy uważają, że wirusy powstały około 3 miliardy lat temu z kwasów nukleinowych organizmów (prokarioty) w wyniku izolacji wolnych fragmentów z genomu, które nabyły zdolność do syntezy otoczki białkowej i podziału (podwójnego, replikacyjnego) wewnątrz komórek. Uważa się, że z genomu bakterii wciąż powstają nowe typy wirusów eukarionty(jądra, plastydy, mitochondria) .
W przyrodzie wirusy mają ogromne znaczenie, ponieważ są wszechobecne i atakują wszystkie grupy organizmów żywych, często powodując różne choroby.
Znanych jest ponad 1000 chorób rośliny wywołane przez wirusy (zawierające RNA). Najczęstsze są różne martwica(obszary martwej tkanki), mozaiki(plamy, plamki, paski na organach roślinnych), w których uszkodzona jest tkanka miąższowa, zmniejsza się liczba chloroplastów, niszczone jest łyko itp.; obserwuje się pomarszczone lub karłowate liście. Wirusy powodują zahamowanie wzrostu roślin, co prowadzi do zmniejszenia plonów.
VZhMT – wirus żółtej mozaiki rzepy, VTM – wirus mozaiki tytoniu, VKKT – wirus krzaczastości pomidora.
Pojawienie się pasków na kwiatach niektórych odmian tulipanów (różnych) jest również spowodowane przez wirusa, ale hodowcy kwiatów sprzedają te tulipany, przedstawiając je jako specjalną odmianę.
U Zwierząt wirusy (zawierające DNA i RNA) powodują choroby takie jak: choroba pryszczycy(u bydła) wścieklizna(u psów, lisów, wilków), myksomatoza(u szczurów) mięsak, białaczka I plaga(u kurczaków) itp. Bardzo często ludzie zarażają się tymi chorobami (poprzez kontakt z zakażonymi zwierzętami).
U osoba Wirusy powodują choroby takie jak: ospa(wirus ospy wietrznej) świnka(paramyksowirus), grypa(myksowirus), oddechowy choroby(ARI; rinowirusy RNA-), zakaźne zapalenie wątroby, paraliż dziecięcy(paraliż dziecięcy; pikornawirus), wścieklizna, opryszczka, AIDS(ludzki wirus niedoboru odporności - HIV).
Grypa - jedyna choroba zakaźna, która objawia się okresowymi, globalnymi epidemiami, niebezpiecznymi dla życia ludzkiego. Właściwości zakaźne wirusa grypy (wpływa na błony śluzowe dróg oddechowych), podobnie jak innych wirusów, zależą od specyficznych białek otoczki wirusa, które stale zmieniają się w wyniku rekombinacji lub mutacji. Dlatego nowe szczepy wirusa grypy powodują nowe epidemie, ponieważ ludzie nie rozwinęli jeszcze na nie odporności.
I tak zimą 1968/69 w USA zarejestrowano 50 milionów przypadków grypa w Hongkongu podczas gdy zginęło 70 000 ludzi. Epidemia z lat 1918/19 ogarnęła cały świat, przebiegała w trzech falach i pochłonęła życie 20 milionów ludzi.
Choroby wirusowe są trudne do leczenia, ponieważ wirusy nie są wrażliwe na antybiotyki. Na szczęście w wielu przypadkach układ odpornościowy zapobiega dalszemu rozprzestrzenianiu się infekcji.
Wielu chorobom wirusowym ludzi i zwierząt można zapobiegać poprzez immunizacja– przeprowadzanie szczepień profilaktycznych, które pozwalają wykształcić odporność na wirusy.
Wirusy są szeroko stosowane przez człowieka w badaniach mikrobiologicznych (biotechnologia, inżynieria genetyczna). Do zwalczania szkodników upraw można wykorzystać wirusy.
W USA z bawełniany woreczek skutecznie walczyć za pomocą wirusa. Ta metoda kontroli jest praktycznie nieszkodliwa - wirus z reguły jest specyficzny gatunkowo (to znaczy wpływa tylko na określony typ organizmu).
Stwierdzono także, że np. wirus nekrotycznej mozaiki ryżu hamuje wzrost ryżu. Ale inne rośliny, np. juta(źródło grubych włókien na torby i liny), rosną lepiej, gdy są zarażone tym wirusem, niż gdy są zdrowe. Naukowcy nie potrafią jeszcze wyjaśnić tego zjawiska.
Bakteriofagi infekują bakterie (wnikają i aktywnie je niszczą), w tym chorobotwórcze. Dzięki temu możliwe jest ich zastosowanie w profilaktyce i leczeniu wielu chorób zakaźnych oraz zwalczaniu bakterii chorobotwórczych: dżuma, dur brzuszny, cholera itd.
Wykład 1
Natura, pochodzenie i struktura wirusów.
Moduł 1
Zintegrowany cel modułu
Kompleksowym celem modułu jest umożliwienie studentom zrozumienia podstawowych właściwości wirusów: ich natury, pochodzenia, architektury i morfologii cząstek wirusowych, typów symetrii i właściwości chemicznych wirusów. Informacje te powinny stać się teoretyczną podstawą do dalszego zrozumienia istoty biologicznej wirusów, która wyraża się w procesach rozmnażania i patogenezie wirusa. Moduł składa się z trzech wykładów, których materiał pozwala na rozwiązanie postawionego celu.
CHARAKTER WIRUSÓW
Od czasu odkrycia wirusów do chwili obecnej poglądy na temat natury wirusów uległy znaczącym zmianom.
D.I. Iwanowski i inni badacze tamtych czasów podkreślili dwie właściwości wirusów, które umożliwiły ich wyizolowanie z ogólnej masy mikroorganizmów: filtrowalność i niezdolność do rozmnażania się we wszystkich sztucznych pożywkach. Później okazało się, że te właściwości nie są absolutne, ponieważ odkryto filtrowalne formy bakterii i mykoplazmy rosnące na sztucznych pożywkach, wielkością zbliżoną do największych wirusów (wirusów ospy ludzkiej i zwierzęcej).
Jednak nawet w przypadku, gdy integracja nie następuje, a genom wirusa znajduje się w stanie autonomicznym, wystąpienie infekcji wynika z konkurencji pomiędzy genomem wirusowym i komórkowym.
Unikalne właściwości wirusa obejmują jego metodę rozmnażania, która znacznie różni się od metod rozmnażania wszystkich innych komórek i organizmów (rozszczepienie binarne, pączkowanie, tworzenie zarodników). Wirusy nie rosną, a ich rozmnażanie określa się mianem rozmnażania dysjunkcyjnego (oddzielnego), co podkreśla brak jedności w przestrzeni (na terytorium komórki) i czasie syntezy składników wirusa (kwasów nukleinowych i białek) z późniejszym składaniem i tworzeniem wirionów.
W związku z powyższym niejednokrotnie pojawiały się dyskusje na temat tego, czym są wirusy - żywymi czy nieożywionymi, organizmami czy nieorganizmami. Oczywiście wirusy mają podstawowe właściwości wszystkich innych form życia - zdolność do reprodukcji, dziedziczność, zmienność, zdolność przystosowania się do warunków środowiskowych; zajmują pewną niszę ekologiczną, podlegają prawom ewolucji świata organicznego na Ziemi. Dlatego w połowie lat 40. rozwinęła się koncepcja wirusów jako najprostszych mikroorganizmów. Logicznym rozwinięciem tych poglądów było wprowadzenie terminu „wirion”, który oznaczał zewnątrzkomórkowy osobnik wirusowy. Jednak wraz z rozwojem badań nad biologią molekularną wirusów zaczęły gromadzić się fakty zaprzeczające idei wirusów jako organizmów.
Brak własnych systemów syntezy białek, dysjunkcyjny sposób rozmnażania, integracja z genomem komórkowym, istnienie wirusów satelitarnych i wirusów wadliwych, zjawiska wielokrotnej reaktywacji i komplementacji – to wszystko nie pasuje do idei wirusy jako organizmy. Pomysł ten traci jeszcze więcej na znaczeniu, gdy spojrzymy na struktury wirusopodobne – plazmidy, wiroidy i czynniki takie jak patogen trzęsawki.
Plazmidy (inne nazwy - episomy, epiwirusy) to dwuniciowy kolisty DNA o masie cząsteczkowej kilku milionów, replikowany przez komórkę. Po raz pierwszy odkryto je u prokariotów, a ich istnienie wiąże się z różnymi właściwościami bakterii, takimi jak oporność na antybiotyki. Ponieważ plazmidy zwykle nie są powiązane z chromosomem bakteryjnym (chociaż wiele z nich jest zdolnych do integracji), uważa się je za pozachromosomalne czynniki dziedziczności.
Plazmidy odkryto także u eukariontów (drożdże i inne grzyby), ponadto zwykłe wirusy zwierząt wyższych mogą występować także w postaci plazmidów, czyli kolistego DNA, pozbawionego własnych białek i replikowanego przez komórkowe enzymy syntezy DNA. W szczególności bydlęce wirusy brodawczaka i małpi wirus 40 (SV-40) mogą występować w postaci plazmidów. Kiedy wirus opryszczki utrzymuje się w hodowli komórkowej, mogą powstać plazmidy – koliste DNA, które stanowią tylko część genomu tego wirusa.
Z wirusami spokrewnione są wiroidy, czynniki odkryte przez T. O. Dinera w 1972 r., które powodują choroby niektórych roślin i mogą być przenoszone jak zwykłe wirusy zakaźne. Badając je, okazało się, że są to stosunkowo małe cząsteczki kolistego superskręconego RNA, składające się z kilku, 300-400 nukleotydów. Mechanizm replikacji wiroidów nie jest do końca jasny.
Na koniec należy wspomnieć o trzęsawce, czynniku wywołującym podostrą pasażowalną encefalopatię gąbczastą u owiec. Prawdopodobnie podobne środki powodują inne formy encefalopatii gąbczastej u zwierząt i ludzi, które opierają się na postępującym niszczeniu komórek nerwowych, w wyniku czego mózg nabywa strukturę gąbczastą (gąbczastą). Czynnik trzęsawki ma charakter białkowy i otrzymał nawet specjalną nazwę - prion (od słów białkowa cząsteczka zakaźna - cząstka zakaźna białkowa). Zakłada się, że białko to jest zarówno induktorem, jak i produktem jakiegoś genu komórkowego, który stał się autonomiczny i wymknął się regulacji („oszalał”).
Wszystkie wirusy, w tym wirusy satelitarne i wadliwe, plazmidy, wiroidy, a nawet czynniki trzęsawki (ich geny), mają coś wspólnego, co je łączy. Wszystkie są autonomicznymi strukturami genetycznymi, zdolnymi do funkcjonowania i rozmnażania się w komórkach zwierząt, roślin, pierwotniaków, grzybów i podatnych na nie bakterii. Najwyraźniej jest to najbardziej ogólna definicja, która pozwala nam nakreślić królestwo wirusów. W oparciu o sformułowaną definicję wirusy, choć nie są organizmami, są jednak wyjątkową formą życia i dlatego podlegają prawom ewolucji świata organicznego na Ziemi.
POCHODZENIE WIRUSÓW
Przyjęto różne założenia dotyczące pochodzenia wirusów. Niektórzy autorzy uważali, że wirusy są wynikiem skrajnego przejawu regresywnej ewolucji bakterii lub innych organizmów jednokomórkowych. Hipoteza ewolucji regresywnej nie może wyjaśnić różnorodności materiału genetycznego wirusów, ich organizacji pozakomórkowej, rozłącznego sposobu rozmnażania i braku systemów syntezy białek. Dlatego obecnie hipoteza ta ma raczej znaczenie historyczne i nie jest podzielana przez większość wirusologów.
Według drugiej hipotezy wirusy są potomkami starożytnych, przedkomórkowych form życia - protobiontów, które poprzedziły pojawienie się komórkowych form życia, od których rozpoczęła się ewolucja biologiczna. Hipoteza ta nie jest obecnie podzielana przez większość wirusologów, ponieważ nie wyjaśnia tych samych kwestii, których pierwsza hipoteza nie była w stanie rozwiązać.
Trzecia hipoteza sugeruje, że wirusy wyewoluowały z elementów genetycznych komórek, które stały się autonomiczne, chociaż nie jest jasne, który z tych elementów dał początek tak różnorodnemu materiałowi genetycznemu wirusów. Hipoteza ta, ironicznie nazwana hipotezą „biegających genów”, znajduje najwięcej zwolenników, jednak nie w pierwotnej formie, w jakiej została wyrażona, gdyż nie wyjaśnia obecności form materiału genetycznego w wirusach (pojedynczych nici DNA, dwuniciowy RNA), brak w komórkach, tworzenie kapsydu, istnienie dwóch form symetrii itp.
Jest prawdopodobne, że wirusy rzeczywiście są pochodnymi elementów genetycznych komórek, ale powstały i ewoluowały wraz z pojawieniem się i ewolucją komórkowych form życia. Natura niejako wypróbowała wszystkie możliwe formy materiału genetycznego (różne typy RNA i DNA) na wirusach, zanim ostatecznie wybrała jego formę kanoniczną - dwuniciowy DNA, wspólny dla wszystkich komórkowych form organizmów, od bakterii po człowieka. Będąc z jednej strony autonomicznymi strukturami genetycznymi, z drugiej strony niezdolnymi do rozwoju poza komórkami, wirusy na przestrzeni miliardów lat ewolucji biologicznej podążały tak różnorodnymi ścieżkami rozwoju, że ich poszczególne grupy nie mają sukcesywnego połączenia z nawzajem. Najwyraźniej różne grupy wirusów powstały w historycznie różnych momentach z różnych elementów genetycznych komórek i dlatego obecnie istniejące różne grupy wirusów mają pochodzenie polifiletyczne, to znaczy nie mają jednego wspólnego przodka. Jednak uniwersalność kodu genetycznego dotyczy także wirusów, wskazując tym samym, że i one są wytworem organicznego świata Ziemi.
ROLA WIRUSÓW W EWOLUCJI
Ponieważ wirusy, będące specjalnymi formami życia, nie są mikroorganizmami, wirusologia nie jest gałęzią mikrobiologii, ale niezależną dyscypliną naukową, która ma swój własny przedmiot badań i własne metody badawcze.
Natura i pochodzenie wirusów
Zmienność antygenowa wirusa grypy i aspekty jego badań.
Rozwiązanie polegające na uzyskaniu skutecznych atenuowanych wariantów wirusa grypy jest utrudnione ze względu na wyjątkową plastyczność i zmienność jego właściwości antygenowych. Prawie coroczne epidemie grypy w różnych odstępach czasu stają się globalne. W ostatnich latach infekcją wywołującą pandemie jest wirus grypy A. Analiza przesunięć antygenowych w obrębie każdego z trzech jej typów pokazuje, że zmiana składu antygenowego szczepów wirusa typu AO na typ A następowała stopniowo, a przejście z typu A1 do A2 był ostry.
Po odnotowaniu w 1957 r. pojawienia się w przyrodzie nowego typu serologicznego A2, przez pewien czas wydawał się on stabilny, choć występowały niewielkie zmiany. Jednak już w 1964 roku nabrały one znaczenia, a po epidemii w Hongkongu wirusy różniły się od siebie tak drastycznie, że przypuszczano, że wyłonił się nowy antygenowy typ A. W trakcie ewolucji wirusa zmieniły się nie tylko właściwości antygenowe białek powierzchniowych , ale także inne cechy. Szczep wirusa grypy wyizolowany podczas epidemii w latach 1971-1972, w przeciwieństwie do wcześniej krążących szczepów, znacznie zwiększył swoją aktywność reprodukcyjną i neuraminidazową, gwałtownie zwiększył termostabilność wirusów i nabył zdolność do regularnego wywoływania wiremii u myszy (Zakstelskaya i in., 1969). ; Sokołow, Podczerniajewa, 1975).
O ile wcześniej wirusy typu B były stosunkowo stabilne, to od 1967 roku nastąpiła ciągła zmiana (Seihachiro, Mitsuo, 1974). W kwietniu–maju 1974 roku wyizolowano nowe szczepy wirusa grypy, z których B/Hong Kong 15/72 uznano za nowy wariant, a inne za pośrednie pomiędzy starymi i nowymi szczepami, co pozwala na ponowne rozważenie danych na temat stabilność antygenową wirusa grypy B i sugerują pojawienie się nowego serotypu.
Wyłania się zatem obraz znaczących zmian antygenowych w obrębie typów A i B. To oczywiście przyciąga szczególną uwagę naukowców pracujących nad problemem grypy. Ponieważ nawet obecność intensywnej odporności w populacji nie może powodować tak dużych zmian antygenowych w wirusie grypy, postawiono hipotezę o okresowości rekombinacji zachodzących między wirusami grypy ludzkiej i zwierzęcej oraz między wirusami ludzkimi i ptasimi. Opracowując tę hipotezę, okazało się, że grypa w naturalny sposób atakuje świnie, konie, indyki, kurczaki, kaczki, rybitwy, a lista ta wciąż rośnie. W ich surowicy krwi znajdują się przeciwciała przeciwko wirusom ludzkiej grypy. Nie jest to zaskakujące, ponieważ fragmentacja genomu wirusa grypy determinuje możliwość rekombinacji nie tylko wewnątrzgatunkowej, ale także międzygatunkowej.
Preparatywne rozdzielenie neuraminidazy i hemaglutyniny otwiera perspektywy na dogłębną analizę związku między indywidualnymi cechami. Niektórzy badacze (Webster i in., 1973; Gorev i in., 1974) zauważają, że rekombinowany wirus jednocześnie z hemaglutyniną nabywa zjadliwości. Istnieje zestaw rekombinantów z określoną hemaglutyniną i neuraminidazą.
Obecnie wiele laboratoriów wirusologicznych na całym świecie bada epizootię grypy i analizuje powiązania antygenowe z ludzką grypą. Prace w tym kierunku są koordynowane i stymulowane przez WHO. Złożoność tego problemu narzuca potrzebę niejednoznacznego podejścia do jego rozwiązania. Równoległych poszukiwań innych podejść do tego zagadnienia nie należy uważać za alternatywę.
W latach 40. i 50. XX w. udowodniono eksperymentalnie pojawienie się wariantów antygenowych podczas pasażu wirusa w organizmie immunizowanych zwierząt (Archetti, Horsfoll, 1960). Zmiany te były dość trwałe, wirusy zachowywały swoją nową specyficzność antygenową w seryjnych pasażach in ovo i przy braku surowicy odpornościowej. Ponadto długotrwałe przenikanie wirusa grypy przez organizmy nieimmunizowanych zdrowych zwierząt zmienia jego właściwości biologiczne. Na przykład K. Paucker (1960) podczas pasaży szczepu PR8 otrzymał przez długi czas wirusa, który był antygenowo odmienny od oryginału i nie był podobny do innych typów wirusa grypy. Autor uważa, że pomiędzy fragmentami 103 i 107 powstał mutant, który następnie zastąpił pierwotnego wirusa. Podobne dane podają K. Zgozelska i wsp. (1973).
Widzimy tu przejaw podstawowego prawa rozwoju każdej populacji, także wirusowej - pula genowa populacji zmienia się w czasie: z jednej strony ulega ona wyczerpaniu w wyniku wymierania organizmów zawierających poszczególne geny, z drugiej strony wzbogaca się w wyniku mutacji dających początek nowym genom.
Prace S. Fazekasa de Sent Grotha, C. Hannouna (1973) nad selekcją spontanicznych mutantów antygenowych wirusa grypy A pod wpływem „immunopressu” (tj. w obecności surowicy immunologicznej) umożliwiły odtworzenie hierarchicznego porządku wirusy w każdym typie. Ponadto we wszystkich swoich wnioskach opierał się na wskaźnikach przekrojowego RZGA. W eksperymentach nad selekcją późnych mutantów uzyskanych za pomocą przeciwciał udało mu się odtworzyć naturalny proces selekcji szczepów epidemicznych. Zaproponował także prosty model oddziaływania przeciwciała z antygenem. Autor przedstawił strefę antygenową otoczki białkowej wirusa w postaci niewielkiej liczby łańcuchów białkowych aminokwasów wystających poza powierzchnię wirusa. Schematycznie wygląda to jak widelec z zębami o różnej długości i szerokości, a odpowiadającymi im przeciwciałami są ubytki uzupełniające część lub wszystkie zęby. Zatem kontakt surowicy odpornościowej z pokrewnym antygenem prowadzi do eliminacji antygenów homologicznych, a antygeny z regionami niekomplementarnymi, czyli mutantami, pozostają w populacji.
Ten diagram przedstawia logiczny rozwój podstawowych zasad immunologii, które pojawiły się w latach 40. XX wieku, dotyczących interakcji antygenu i przeciwciała oraz teorii biosyntezy przeciwciał. Według tych prac grupa aktywna przeciwciał ma konfigurację dodatkową w stosunku do konfiguracji grupy determinującej antygen. Założono, że grupy te odnoszą się do siebie jak obiekt do swojego lustrzanego odbicia. K. Landsteiner (1946) przeprowadził doświadczenia ze sztucznym antygenem otrzymanym w wyniku kompleksowania cząsteczek białka z różnymi związkami drobnocząsteczkowymi, które wykazały, że o specyficzności tego antygenu może decydować jedynie niewielka grupa przyłączona do białka. Przeciwciała nie „rozpoznają” antygenu, jeśli różni się on jedynie pozycją grupy metylowej w pierścieniu aromatycznym od tej, która stymulowała powstawanie tych przeciwciał, lub przestrzennym położeniem grupy hydroksylowej (Boyd 1969).
Wracając zatem do zagadnienia zmienności antygenowej wirusa, można stwierdzić rolę selekcyjną przeciwciał w tym procesie. To, w jaki sposób zmutowane cząstki powstają w populacji wirusów, jest jednym z pytań, na które należy odpowiedzieć, aby zrozumieć ewolucję wirusów grypy.
Każda populacja wirusa zawiera spontaniczne mutanty, które powstają w wyniku działania czynników zewnętrznych lub wewnętrznych. W zależności od nabytych właściwości mutant może mieć przewagę w reprodukcji i dominować w populacji. W niektórych przypadkach możliwe jest zidentyfikowanie czynnika, który odegrał decydującą rolę w pojawieniu się mutanta. Pandemia z 1918 roku wzbudziła największe zainteresowanie badaczy zajmujących się problematyką grypy, gdyż jej wirus był niezwykle chorobotwórczy dla człowieka. Retrospektywna analiza tego wirusa doprowadziła niektórych badaczy do przekonania, że pandemię spowodował wirus grypy świń wyizolowany w 1930 r., ponieważ szczepy te mają antygeny spokrewnione z wirusami świńskiej grypy. Według innego punktu widzenia wzrost aktywności wirusa spowodowany jest pojawieniem się zmutowanych cząstek pod wpływem gazu musztardowego, który był używany podczas I wojny światowej, a więc przed pandemią grypy (Blashkovich 1966). Rzeczywiście gaz musztardowy jest niezwykle silnym biologicznie aktywnym środkiem chemicznym. Jego działanie mutagenne po raz pierwszy wykazali C. Auerbach i T. M. Robson (1946). Jednocześnie stwierdzono, że gaz musztardowy ma bezpośrednie działanie mutagenne na chromosomy. Później odkryto, że gaz musztardowy może powodować mutacje wirusów i bakterii. W związku z tym nie można wykluczyć jego potencjalnej roli jako czynnika mutagennego, jeśli weźmiemy pod uwagę, że czynniki chemiczne i fizyczne mogą powodować zmiany genetyczne w obiektach biologicznych na wszystkich etapach rozwoju, a wirusy najwyraźniej nie są wyjątkiem.
Czynniki, które w warunkach naturalnych mogą działać jako mutageny, obejmują leki farmakologiczne. Istnieją prace analizujące związek pomiędzy działaniem teratogennym a budową chemiczną cząsteczek leku; W mikroorganizmach obserwuje się podobne zjawisko powszechnego pojawiania się zmutowanych form lekoopornych. W szczytowym okresie grypy, gdy wirus rozmnaża się w organizmie, pacjenci przyjmują leki będące syntetycznymi związkami chemicznymi.
Wiadomo, że środki przeciwwirusowe są dość skuteczne tylko wtedy, gdy są w stanie selektywnie hamować syntezę kwasów nukleinowych, to znaczy wchodzą w bezpośredni kontakt z aparatem genetycznym. Najwyraźniej ze względu na specyfikę genomu wirusa grypy granica pomiędzy czysto przeciwwirusowym i mutagennym działaniem związków chemicznych jest łatwa do przekroczenia.
Nasze doświadczenia badające wpływ związków chemicznych na specyficzność antygenową wirusów grypy należących do serotypu AO wykazały, że niektóre związki z klasy supermutagenów mogą powodować zmiany, które nie wykraczają poza serotyp homologiczny. W szczególności dwóch pierwszych przedstawicieli nitrozoalkilomoczników indukowało mutacje tej cechy (Chulanova, 1968; Akhmatullina i in. 1974). Wykorzystaliśmy zaproponowaną przez nas modyfikację RZGA, która umożliwiła ustalenie współczynnika Ap i na jego podstawie określenie stopnia różnicy w specyficzności antygenowej wirusów dzikich i zmutowanych.
Eksperymenty z dużym zestawem związków chemicznych ujawniły wśród nich jeszcze jeden czynnik – 1,4-bis-diazoacetylobutan, który wykazuje aktywność mutacyjną w oparciu o specyficzność antygenową. Zastosowaliśmy także metodę immunopressu, po ekspozycji na mutagen wirus pasażowano w obecności surowicy homologicznej. Niezmodyfikowane cząstki wirusa zobojętniono komplementarnymi przeciwciałami i stworzono warunki selektywne dla indukowanych mutantów. Powstałe mutanty antygenowe badano w teście reakcji krzyżowej z surowicą na dzikie i zmutowane wirusy oraz w reakcji strącania i wykazały znaczące przesunięcia antygenowe.
Zatem dalsze badania eksperymentalne indukowanych mutantów z wykorzystaniem dużego zestawu związków chemicznych dostarczą informacji na temat badanego problemu.
Grypa. Leczenie i profilaktyka.
Grypa jest ostrą chorobą zakaźną górnych dróg oddechowych. Niebezpieczna sama w sobie grypa zaostrza przebieg innych chorób przewlekłych i powoduje poważne powikłania ze strony układu krążenia, ośrodkowego układu nerwowego, narządów trawiennych, nerek itp. Grypa jest najbardziej niebezpieczna dla dzieci i osób starszych. Szybkość rozprzestrzeniania się grypy, nasilenie choroby, częstość powikłań, a czasami śmierć – to wszystko sprawia, że jej zapobieganie jest szczególnie ważne. Osoby uprawiające sport i gimnastykę są znacznie mniej narażone na zakażenie wirusem grypy. Znanych jest kilka typów wirusa grypy – A, B, C itd.; pod wpływem czynników środowiskowych ich liczba może wzrosnąć. Ze względu na to, że odporność na grypę jest krótkotrwała i specyficzna, możliwe jest powtórne zachorowanie w ciągu jednego sezonu. Według statystyk na grypę choruje co roku średnio 20-35% populacji.
Źródłem zakażenia jest osoba chora; Najbardziej niebezpieczni jako roznosiciele wirusa są pacjenci z łagodną postacią wirusa, ponieważ nie izolują się na czas – chodzą do pracy, korzystają z transportu publicznego, odwiedzają miejsca rozrywki.
Zakażenie przenoszone jest z chorego na zdrowego drogą kropelkową unoszącą się w powietrzu podczas rozmowy, kichania, kaszlu lub przez przedmioty gospodarstwa domowego.
Okres utajony grypy trwa od 1 – 12 godzin do 3 dni. Choroba zaczyna się ostro: gwałtowny wzrost temperatury do 38-400, dreszcze, ból głowy, ból kości i mięśni, ogólne zmęczenie; występują bóle i bóle gardła, zaburzenia smaku i węchu; Po 12-24 godzinach pojawia się wydzielina z nosa.
Temperatura utrzymuje się 1-3 dni, czasem do 6-7 dni. Z reguły pod koniec pierwszego tygodnia temperatura wraca do normy. Przy odpowiednim leczeniu i pielęgnacji powrót do zdrowia następuje w ciągu 7-9 dni.
W przypadku podejrzenia grypy pacjenta należy odizolować i położyć do łóżka. Należy to zrobić przed przybyciem lekarza. Biorąc pod uwagę, że patogeny grypy są bardzo niestabilne w środowisku zewnętrznym i łatwo ulegają zniszczeniu pod wpływem tlenu i środków dezynfekcyjnych, pomieszczenie należy regularnie wietrzyć. Przynajmniej raz dziennie wyczyść pokój na mokro, używając wybielacza, formaldehydu, sody, chloraminy i mydła do prania.
Pacjent musi mieć indywidualne naczynia. Naczynia i naczynia pacjenta należy umyć wrzącą wodą z dodatkiem sody oczyszczonej lub poddać działaniu 5% roztworu chloraminy. Obowiązkowa jest systematyczna dezynfekcja bielizny i pościeli pacjenta poprzez wygotowanie w roztworze mydła.
Wszystkie leki przepisane przez lekarza należy przechowywać w specjalnie do tego przeznaczonym miejscu. Oprócz leków wskazane jest picie dużej ilości płynów we wszystkich okresach choroby: herbaty z miodem lub cytryną, soku żurawinowego, ciepłego mleka, soków owocowych i warzywnych. Jedzenie musi być wysokokaloryczne. Należy ściśle przestrzegać zaleceń lekarza. Samoleczenie jest niedopuszczalne. Leków nie można przyjmować bez recepty. Szczególną ostrożność należy zachować w przypadku antybiotyków i sulfonamidów – nie działają one na wirusa grypy, a przyjmowane bez pozwolenia i w niewłaściwych dawkach mogą powodować reakcje alergiczne. Ale bezboleśnie można zastosować kąpiele do stóp, plastry musztardowe, cebulę, czosnek. Uwalniane przez płuca olejki eteryczne zawarte w cebuli i czosnku wzmagają wydzielanie śluzu, ułatwiając tym samym łatwiejsze odkrztuszanie w przypadku chorób układu oddechowego.
W służbie zdrowia dostępny jest także szereg specyficznych środków przeciw grypie, do których zalicza się przede wszystkim żywa szczepionka oraz specjalne serum zawierające białka ochronne. Lekami wprowadzonymi do praktyki są interferon i maść oksolinowa.
Hartowanie, zbilansowana dieta, świeże powietrze i terminowe leczenie chorób przewlekłych pomogą Ci zapobiec przeziębieniom, zwłaszcza grypie.
Uważa się, że wirusy (od łac. wirus- trucizna) - coś paskudnego, co przynosi same kłopoty. Jest to jednak poważny błąd. Wirusy są kluczowymi twórcami żywej przyrody i motorami jej ewolucji.
Jednym z głównych argumentów przeciwko hipotezie, że wirusy „uciekły” z komórek, jest fakt, że wirusowe systemy genetyczne są znacznie bardziej zróżnicowane niż komórkowe. Jak wiadomo, organizmy komórkowe mają jedynie dwuniciowe – liniowe lub koliste – genomy DNA. Genom wirusa może być reprezentowany zarówno przez jednoniciowe, jak i dwuniciowe cząsteczki RNA lub DNA, liniowe lub koliste. Istnieją również systemy wykorzystujące odwrotną transkrypcję. Zatem w retrowirusach (na przykład niektórych onkowirusach, HIV) i pararetrowirusach (wirusy zapalenia wątroby typu B, mozaika kalafiora itp.) Jeden z łańcuchów genomowego DNA jest syntetyzowany na matrycy RNA. Wirusy, w przeciwieństwie do organizmów komórkowych, wykorzystują wszystkie teoretycznie możliwe sposoby przechowywania i wyrażania informacji genetycznej.
Drugim ważnym argumentem przeciwko uznawaniu wirusów za pochodzące z komórek jest to, że istnieje wiele genów wirusowych, które nie występują w organizmach komórkowych. Organizmy komórkowe nie tylko wyewoluowały z wirusów, ale także odziedziczyły (i nadal dziedziczą) po nich znaczną część swojego materiału genetycznego. Szczególnie interesujące pod tym względem są wirusy endogenne (części genomu wirusów RNA lub DNA zintegrowane z genomem komórki), wśród których dominują geny pochodzące od retrowirusów. Uważa się, że ssaki odziedziczyły ponad połowę swojego genomu od wirusów i ich najbliższych krewnych - „samolubnych” elementów genetycznych, na przykład plazmidów i transpozonów. Zatem wirusy są współrodzicami ludzi. Często sekwencje genów endogennych wirusów, które występują w dużych ilościach w ludzkim genomie, ulegają zmianie i nie kodują już białek. Istnieją uzasadnione podstawy, aby sądzić, że takie sekwencje biorą udział w regulacji genów komórkowych, chociaż ich specyficzne funkcje biologiczne są często nieznane. Wiemy jednak coś ważnego: na przykład białko syncytyna, kodowane przez gen otoczki jednego z endogennych retrowirusów, jest niezbędne do fuzji komórek podczas tworzenia łożyska. Oznacza to, że ani ludzie, ani zwierzęta łożyskowe nie mogliby urodzić się bez tego endogennego wirusa. Jest jeszcze jeden ważny przykład. Okazało się, że składnik genomu jednego z endogennych wirusów kontroluje ekspresję dehydrogenazy prolinowej w niektórych obszarach ośrodkowego układu nerwowego. Enzym ten mógł odegrać ważną rolę w ewolucji ludzkiego mózgu. Jeśli w wyniku mutacji zaburzona zostanie ekspresja tego enzymu, dochodzi do chorób psychicznych, w tym schizofrenii. Wirusy i ich krewni odgrywają również ważną rolę w poziomym przenoszeniu genów komórkowych - z jednego organizmu do drugiego.
Jednak pomimo ich kluczowej roli w ewolucji, wirusy są najbardziej znane jako patogeny ludzi, zwierząt i roślin (swoją drogą, po to je odkryto). A potem porozmawiamy o naturze patogeniczności wirusa. Wirusy (zwłaszcza wirusy eukariotyczne) nie mają szczególnej „chęci” wyrządzenia szkody gospodarzowi, a tym bardziej zabicia go. W wielu przypadkach wirusy współistnieją z komórkami dość pokojowo i przyjaźnie. Dlaczego tak wiele wirusów jest tak szkodliwych? Zwykle wyjaśnia się, że patologia zakażonej komórki wynika z „grabieży” jej zasobów (materialnych i strukturalnych), które wirus kieruje na własne potrzeby reprodukcyjne. Jednak największą szkodę mogą wyrządzić nierozsądne działania ochronne żywicieli i działanie ochronne wirusów, które nie jest bezpośrednio związane z ich rozmnażaniem.
Mechanizmy ochrony i przeciwobrony
Jakie są główne mechanizmy obronne zakażonej komórki? Są to elementy odporności wrodzonej: degradacja RNA (wirusowego i komórkowego), hamowanie syntezy białek (zarówno wirusowych, jak i komórkowych), samozniszczenie (apoptoza i inne rodzaje zaprogramowanej śmierci) czy wreszcie stan zapalny. Właściwie wiele wirusów odkryło swoje istnienie w ten sposób – ze względu na wywoływane przez nie stany zapalne (zapalenie mózgu, zapalenie płuc itp.). Komórka walczy z wirusem, zakłócając swój własny metabolizm i/lub strukturę, a jej mechanizmy obronne są zwykle samouszkadzające. Można powiedzieć, że osoba, która umiera na polio (a zdarza się to mniej niż 1%), popełnia samobójstwo, walcząc z infekcją.
W odpowiedzi na mechanizmy obronne komórek wirusy ewoluują, tworząc mechanizmy obronne, co powoduje wyścig zbrojeń pomiędzy wirusem a komórką. Leki te są skierowane przede wszystkim przeciwko ogólnym procesom metabolicznym leżącym u podstaw reakcji obronnych komórki. To znowu jest hamowanie syntezy komórkowego RNA i białek, zakłócenie infrastruktury wewnątrzkomórkowej i transportu komórkowego, supresja lub odwrotnie, uruchomienie apoptozy i innych mechanizmów powodujących zaprogramowaną śmierć komórki. Zatem strategia obronna wirusa jest pod wieloma względami podobna do zachowania obronnego komórki. Mówiąc obrazowo, zapaśnicy używają tych samych technik i osiągają te same cele. Na przykład komórka, hamując syntezę białek wirusowych, wykorzystuje interferon, a aby zahamować jego powstawanie, wirus z kolei hamuje syntezę białek w komórce. W zależności od okoliczności jedna lub druga strona zyskuje. Okazuje się, że głównym wkładem w patologię nie jest reprodukcja wirusa jako takiego, ale konfrontacja między obroną komórkową a obroną wirusową. W patologii roślin koncepcja „tolerancji” istnieje od dawna: wirus chorobotwórczy może aktywnie namnażać się w zakażonej roślinie, nie powodując bolesnych objawów.
Poniżej będziemy mówić głównie o wirusach RNA (jest to prostszy przykład). W jaki sposób wirus RNA, gdy dostanie się do komórki, ujawnia swoją obecność? A skąd komórka wie, że dostał się do niej wirus? Główną cechą, dzięki której komórka „rozumie” jest wirusowy dwuniciowy RNA, który w zasadzie może powstać w niezainfekowanej komórce, ale nie w takich ilościach i miejscach. W niektórych przypadkach komórka rozpoznaje również wirusowe jednoniciowe RNA, a czasami (znacznie rzadziej) białka wirusowe. Ważne jest, aby rozpoznanie wirusowego RNA było nieswoiste: „wyczuwszy” dwuniciowy RNA, komórka może „myśleć”, że przedostał się do niej wirus, ale nie wie, który. RNA jest wychwytywane przez dwa typy czujników: Toll-like (z ang. płatne i od niego. myto- niezwykłe) receptory i wyspecjalizowane helikazy RNA. Obejmują szereg mechanizmów ochronnych na poziomie transkrypcji, w tym tworzenie interferonu. Ponadto wirusowe RNA są rozpoznawane przez „wykonawców” - dwuniciową kinazę białkową zależną od RNA PKR, która fosforyluje niektóre czynniki inicjacji translacji, hamując w ten sposób syntezę białek; syntetaza oligoadenylanowa (OAS), która aktywuje RNazę L, która rozszczepia RNA; System interferencji RNA, prowadzący do degradacji RNA i zakłócenia jego translacji.
Ponieważ wirus jest rozpoznawany jako coś niespecyficznego, komórka nie może poznać swoich „intencji”. Ogólnie rzecz biorąc, niemożliwe byłoby wymyślenie indywidualnego, wrodzonego systemu obrony przed jakimkolwiek możliwym wirusem. Oznacza to, że komórka może walczyć z wirusem jedynie przy użyciu standardowych technik. Dlatego też jej działania obronne są często nieproporcjonalne do istniejącego zagrożenia. Jeśli jednak reakcje obronne komórki są tak niespecyficzne, dlaczego różne wirusy nadal powodują różne choroby? Po pierwsze, każdy wirus może infekować tylko określony typ komórek w określonym organizmie. Wynika to z faktu, że aby przeniknąć do komórki, musi ona oddziaływać z receptorami komórkowymi, które są dla niej „odpowiednie”. Ponadto do namnażania wirusów wymagane jest określone środowisko wewnątrzkomórkowe (często potrzebne są określone białka komórkowe). Po drugie, chociaż reakcje obronne komórki są standardowe, mechanizmy obronne wirusa są w dużej mierze indywidualne, chociaż są skierowane przeciwko standardowym mechanizmom komórkowym.
W roślinach interferencja RNA odgrywa bardzo ważną rolę jako mechanizm przeciwwirusowy. Z wirusowego RNA powstaje dwuniciowy RNA (ważny czynnik, dzięki któremu komórka dowiaduje się o obecności wirusa). Przy udziale składników układu interferencyjnego RNA – enzymu Dicer, który tnie ten dwuniciowy RNA na fragmenty o długości 21-25 par nukleotydów, a następnie kompleksu RNA-białko RISC – ostatecznie powstają jednoniciowe krótkie fragmenty RNA uformowany. Hybrydyzując z wirusowym RNA, powodują jego degradację lub hamowanie translacji. Ten mechanizm ochronny jest skuteczny, ale może uszkodzić samą komórkę, co wyraźnie widać na przykładzie wiroidów. Są to patogeny roślinne, krótkie (kilkaset nukleotydów) okrągłe, jednoniciowe cząsteczki RNA niepokryte białkową otoczką. Wiroidy nie kodują białek, ale mogą powodować poważne objawy u zakażonej rośliny. Dzieje się tak, ponieważ komórka się chroni. Powstały wiroidowy dwuniciowy RNA jest poddawany działaniu wszystkich składników układu interferencji RNA, co powoduje utworzenie jednoniciowych fragmentów RNA, które hybrydyzują nie z wirusowym RNA, ale z komórkowym RNA. Prowadzi to do jego degradacji i rozwoju objawów chorobowych. Jednakże wiele wirusów roślinnych koduje różnorodne białka, które zakłócają interferencję RNA ( wirusowe supresory wyciszania RNA - VSR). Hamują one rozpoznawanie i cięcie wirusowego RNA lub hamują tworzenie i funkcjonowanie kompleksu RISC. Dlatego te białka VSR mogą zakłócać ważne fizjologicznie (niewirusowe) mechanizmy interferencji RNA, powodując objawy patologiczne.
Białka zabezpieczające
Obrona wirusów, w szczególności pikornawirusów, patogenów zawierających małe RNA, w dużej mierze zależy od pracy takich białek. Ta duża grupa obejmuje w szczególności patogeny poliomyelitis, wirusowego zapalenia wątroby typu A, pryszczycy itp. Osobliwością tych wirusów jest to, że, z nielicznymi wyjątkami, ich białka są syntetyzowane w postaci pojedynczej poliproteiny, z z których następnie powstają poszczególne dojrzałe białka. Wśród nich można wyróżnić trzy grupy. Pierwsza składa się z kluczowych białek - niezbędnych, o ustalonych funkcjach, bezpośrednio zapewniających reprodukcję wirusa: polimerazy RNA zależne od RNA, niezbędne do replikacji genomu wirusa; białka kapsydu tworzące otoczkę białkową wirusa; proteazy biorące udział w procesie przekształcania poliprotein w dojrzałe białka; Białko VPg ( połączony genom białka wirusa- białko wirusowe połączone z genomem), które służy jako starter do syntezy cząsteczek RNA; Helikaza jest bardzo cennym enzymem, który mają wszystkie pikornawirusy, ale odgrywa rolę, która nie jest do końca jasna. Do drugiej grupy zaliczają się również białka witalne, ale te, które wykonują pracę „pomocniczą” - hydrofobowe białka „przewodnikowe” 2B i 3A. Kierują kluczowe białka do miejsc docelowych i pomagają stworzyć optymalne środowisko wewnątrzkomórkowe do reprodukcji wirusa. Do trzeciej grupy zalicza się białko liderowe L, odkryte w naszym laboratorium 30 lat temu oraz białko 2A; nazwaliśmy je białkami „bezpieczeństwa” ( bezpieczeństwo- bezpieczeństwo). Jest to wyspecjalizowana „broń” przeciwobronna pikornawirusów. Ogólnie rzecz biorąc, wszystkie trzy klasy białek mogą zwalczać mechanizmy obronne komórki. Jednak białka kluczowe i białka przewodnie wykonują tę pracę w niepełnym wymiarze godzin, ponieważ mają inne ważne obowiązki, którym musi sprostać ich struktura i funkcja. W konsekwencji ich możliwości obronne są ograniczone koniecznością wykonywania podstawowych prac. Ale wiewiórki „bezpieczeństwa” pracują na pełny etat w swojej specjalności - ewolucja „zatrudniła” je specjalnie dla „bezpieczeństwa” (później niektóre z nich „nauczyły się” robić coś innego). Mogą mieć dowolną strukturę niezbędną do wykonywania swoich obowiązków.
Jedną z najważniejszych funkcji białek zabezpieczających jest to, że biorą one udział w ustalaniu losu zainfekowanej komórki. Istnieje wiele różnych możliwości jego śmierci, ale dwa główne, najbardziej znane mechanizmy to martwica i apoptoza, które różnią się cechami morfologicznymi i biochemicznymi. Podczas martwicy komórka ulega lizie, a jej zawartość wylewa się do przestrzeni międzykomórkowej. Podczas apoptozy na jej powierzchni tworzą się wyraźnie widoczne wypukłości, DNA ulega rozkładowi na fragmenty nukleosomalne, a ostatecznie komórka ulega fragmentacji na pojedyncze ciała apoptotyczne ograniczone do błony komórkowej. Bardzo ważne jest, w jaki sposób dokładnie komórka umiera. W przypadku martwicy rozwija się ochronne zapalenie, ale wirus opuszcza komórkę i rozprzestrzenia się. W przypadku apoptozy rozprzestrzenianie się wirusa jest ograniczone i zwykle nie występuje reakcja zapalna. Śmierć zakażonej komórki jest z reguły aktem poświęcenia, który ogranicza reprodukcję wirusa.
Odkryliśmy, że infekcja pikornawirusami, w szczególności wirusem polio (wirusem polio), uruchamia program apoptozy komórki. Zachodzi to jednym z klasycznych szlaków, kiedy cytochrom jest uwalniany z mitochondriów C aktywowana jest kaskada enzymów proteolitycznych, kaspaz. Ale z drugiej strony okazało się, że wirusy mają mechanizm antyapoptotyczny - zdolność tłumienia reakcji apoptotycznej komórki. Zatem komórki HeLa zakażone wirusem polio lub wirusem zapalenia mózgu i mięśnia sercowego (także pikornawirusem) umierają z objawami martwicy. Ale jeśli wyłączysz „broń” antyapoptotyczną (stłumisz syntezę białek wirusowych), komórka umiera z powodu apoptozy (samopoświęcenia). W obu wirusach taką bronią są białka „bezpieczeństwa”. Natomiast w wirusie zapalenia mózgu i mięśnia sercowego rolę tę pełni białko L, a w wirusie polio – białko 2A. Białko liderowe nie ma aktywności enzymatycznej, natomiast białko 2A jest proteazą. Nie mają ze sobą nic wspólnego ani strukturalnie, ani biochemicznie, ale oba mają działanie antyapoptotyczne w oparciu o różne mechanizmy molekularne.

Innym mechanizmem antyochronnym białek zabezpieczających pikornawirusa jest zakłócenie transportu jądrowo-cytoplazmatycznego [10–12]. Wykazaliśmy, że po zakażeniu tymi wirusami zwiększa się przepuszczalność błony jądrowej i zostaje zakłócona aktywna wymiana makrocząsteczek między cytoplazmą a jądrem. A jeśli struktura komórki zostanie uszkodzona, nie będzie mogła uruchomić mechanizmów regulacyjnych w celu zwalczania wirusa. W wirusie polio białko zabezpieczające 2A zakłóca transport jądrowo-cytoplazmatyczny poprzez hydrolizę nukleoporyn, składników porów jądrowych. A białko liderowe wirusa zapalenia mózgu i mięśnia sercowego działa - wpływa na komórkową kaskadę fosforylacji nukleoporyn [,].
Przeciwochronna funkcja białek „bezpieczeństwa” może objawiać się na inne sposoby. Zatem białka L kardiowirusów (w tym wirusa zapalenia mózgu i mięśnia sercowego) i białka 2A enterowirusów (w tym wirusa polio) hamują tworzenie interferonu. Jego działanie jest hamowane przez białko L wirusa pryszczycy i białko 2A wirusa polio. Jednakże białka „bezpieczeństwa” pikornawirusów nie są istotne. Można usunąć obu strażników lub spowodować w nich duże delecje (jak w przypadku białka L kardiowirusów, białek 2A wirusa zapalenia wątroby typu A i kardiowirusów), bez przywrócenia życia wirusowi.
Wzajemne rozbrojenie

Jakie będą konsekwencje inaktywacji wirusowych białek „bezpieczeństwa” dla komórki? Z jednej strony wzrośnie wrażliwość wirusów na mechanizmy ochronne wrodzonej odporności komórkowej. Ale z drugiej strony wzrośnie także jego samookaleczająca się aktywność samobójcza. Co się stanie, jeśli jednocześnie wyłączysz mechanizmy obronne komórki i wirusa? Badaliśmy tę sytuację na przykładzie interakcji pomiędzy mengowirusem (szczepem wirusa zapalenia mózgu i mięśnia sercowego) a komórkami HeLa. Zainfekowane wirusem typu dzikiego szybko umierają z powodu martwicy. A jeśli wirus zostanie częściowo rozbrojony (białko liderowe jest inaktywowane), komórki HeLa żyją trochę dłużej i umierają nie z powodu martwicy, ale z powodu apoptozy. Kiedy wzajemna obrona zostaje zmniejszona (apoptoza zostaje w komórce wyłączona przez związek chemiczny hamujący kaspazy, a białko liderowe wirusa zostaje inaktywowane), nawet po dwukrotnie dłuższym czasie komórki czują się znacznie lepiej niż te, które nie zostały poddane rozbrojony. A reprodukcja wirusa (zarówno dynamika, jak i zbiory) przebiegała dokładnie w ten sam sposób, niezależnie od tego, czy wyłączono tylko jego mechanizmy obronne, czy też w tym samym czasie usunięto także mechanizmy obronne komórkowe. Okazuje się, że w komórkach, które nie mają jeszcze poważnych uszkodzeń patologicznych (tzw. efekt cytopatyczny), może już powstać wiele cząsteczek wirusa. Zatem uszkodzenie komórek nie jest konieczne, aby wirus mógł się rozmnażać. Dlatego skuteczną strategią terapii przeciwwirusowej mającą na celu łagodzenie objawów choroby może być jednoczesne tłumienie mechanizmów obronnych zarówno wirusowych, jak i komórkowych.
Zaprogramowana śmierć
Ta seria naszych eksperymentów dała również okazję do głębszego wniknięcia w naturę śmierci martwiczej powodowanej przez wirusa. Co to jest – zabicie komórki przez wirusa lub jej samobójstwo (poświęcenie), gdy uzna, że dla dobra wspólnego bardziej celowe jest umrzeć? Uszkodzeniom martwiczym ulegają:
- błona plazmatyczna (zwiększa się jej przepuszczalność, tworzą się „pęcherzyki”),
- cytoplazma (wymiana mikrotubul i mikrofilamentów),
- jądro (kurczy się, odkształca, chromatyna ulega kondensacji),
- aktywność metaboliczna (reakcje redukcji zależne od NADH, zmiana żywotności).
Kiedy apoptoza jest wyłączona (dodanie chemicznego inhibitora kaspazy), różne zmiany martwicze zależą od tego, czy wirusowe białko liderowe działa, czy nie. Przykładowo, jeśli zostanie on inaktywowany, nie zmienia się przepuszczalność błony komórkowej, nie pojawiają się „pęcherze” związane z zaburzeniem równowagi osmotycznej i nie pojawia się szereg innych zmian martwiczych. Jednym z możliwych wyjaśnień tego efektu jest to, że białko L działa na wiele celów w różnych przedziałach komórkowych. Ponieważ jednak białko jest małe i nie ma aktywności enzymatycznej, bardziej prawdopodobne jest, że jego bezpośrednie cele są znacznie mniejsze. Stawiamy hipotezę, że białko liderowe działa na jeden lub więcej kluczowych elementów komórkowych kontrolujących losy komórki, w wyniku czego uruchamiany jest jej program nekrotyczny, który jest odpowiedzialny za większość wymienionych zmian patologicznych. W rezultacie to nie wirus nekrotycznie zabija komórkę, ale sama komórka popełnia samobójstwo (dokonuje aktu poświęcenia). Ten punkt widzenia jest spójny z nowymi pomysłami, zgodnie z którymi oprócz apoptozy istnieje szereg innych ważnych fizjologicznie rodzajów programowanej (zakodowanej w genomie komórkowym) śmierci komórki, w tym nekroptoza, która jest podobna do martwicy.
Zatem samopoświęcenie komórek podczas infekcji wirusowej może objawiać się nekroptozą lub apoptozą. Nekroptoza może być reakcją ochronną komórki na infekcję wirusową i to nie tylko w przypadku pikornawirusów. To, który mechanizm jest bardziej korzystny dla wirusa, zależy od warunków. Widzimy, że jego działanie antyochronne może objawiać się w postaci „przekierowania” mechanizmów zakodowanych w genomie komórki. Jest to ważna (choć nie jedyna) metoda obrony i jeden z głównych mechanizmów patogeniczności wirusów. Programy apoptozy i martwicy wywołane wirusami konkurują ze sobą. Pokazaliśmy, że gdy komórki HeLa zostaną zakażone wirusem polio, najpierw aktywowana jest apoptoza, a następnie zostaje ona stłumiona i uruchomiony zostaje szlak nekrotyczny. Zatem infekcja komórki wirusem aktywuje w niej szereg działań ochronnych, wśród których występują dwa samobójcze mechanizmy zaprogramowanej śmierci - apoptotyczny i nekrotyczny. Następnie dochodzi do rywalizacji między tymi ścieżkami: tłumienie jednej z nich aktywuje drugą i odwrotnie. A wszystko to regulują białka komórkowe, białka wirusowe (przede wszystkim białka „bezpieczeństwa”), a także czynniki zewnętrzne.
Wyścig zbrojeń
Ponieważ komórki mają mechanizmy obronne i wirusy mają mechanizmy obronne, naturalnie istnieje między nimi wyścig zbrojeń. Niekonserwatywny charakter białek zabezpieczających sugeruje, że są one przystosowane do przeciwdziałania mechanizmom obronnym konkretnego gospodarza. Dlatego też jego zmianie może towarzyszyć utrata funkcji białka „bezpieczeństwa” i w konsekwencji nasilenie reakcji obronnych gospodarza. To może wyjaśniać szczególną patogeniczność „nowego” ( nowo powstające- pojawiające się) wirusy. Zatem wirus grypy jest mało patogennym, prawie nieszkodliwym wirusem jelitowym dzikiego ptactwa. W przypadku zarażenia człowieka może wystąpić hiszpańska grypa, ptasia grypa lub świńska grypa. Wirus SARS jest stosunkowo bezpieczny dla nietoperzy, jednak u ludzi powoduje ciężki ostry zespół oddechowy, któremu towarzyszy wysoka śmiertelność. Wreszcie wirus HIV (a dokładniej jego przodek) jest praktycznie nieszkodliwy dla małp, ale u ludzi powoduje AIDS. Bardzo ważne jest, aby wirusy te po przeniesieniu się do nowego żywiciela nie rozwinęły nowych czynników chorobotwórczych (po prostu w wyniku kilku mutacji zapewniających penetrację komórki nabywają zdolność do zakażania człowieka). Innym możliwym mechanizmem braku równowagi między wirusem a żywicielem i pojawieniem się nowych patogenów może być zmiana broni przeciwwirusowej, na przykład utrata starej lub nabycie nowego białka „bezpieczeństwa”.
Jednakże długoterminowa koewolucja żywiciela i wirusa powinna doprowadzić do zmniejszenia patogeniczności tego ostatniego (obustronnie korzystne rozbrojenie). Klasycznym przykładem jest wirus śluzaka/włókniaka. W połowie XIX wieku. Króliki europejskie zostały sprowadzone do Australii, szybko się rozmnożyły i stały się poważnym zagrożeniem dla rolnictwa. 100 lat później do kontrolowania ich populacji zaczęto wykorzystywać patogenny wirus włókniaka/śluzaka (z rodziny wirusów ospy, do której zalicza się wirus ospy). Różne króliki różnie reagują na tego wirusa. U królików brazylijskich trzy tygodnie po zakażeniu powoduje łagodny guz – włókniak (zlokalizowany guzek na skórze). Jednak u królików europejskich wrażliwych na tego wirusa w ciągu 10 dni po zakażeniu rozwija się uogólniona choroba śmiertelna.
Wirus wprowadzony do Australii spowodował letnie epidemie przenoszone przez komary, podczas których ponad 99% zakażonych królików zmarło w niecałe dwa tygodnie. Mniej zjadliwe warianty wirusa miały większe szanse przetrwać zimę, co doprowadziło do selekcji osłabionych (atenuowanych) szczepów. A po około 10 latach śmiertelność europejskich królików z powodu wyewoluowanego wirusa spadła o połowę. Jednocześnie wybrano oporne króliki: ich śmiertelność z powodu pierwotnego wirusa spadła około czterokrotnie. W ciągu zaledwie dziesięciu lat (okres znikomy z punktu widzenia ewolucji) związek między patogenem a żywicielem poprawił się około 10-krotnie. Jest to oczywiście nieco uproszczony schemat, ponieważ wyścig zbrojeń nie ustaje: w odpowiedzi na zwiększoną oporność u królików może również wzrosnąć zjadliwość wirusa. Jest to jednak uderzający przykład roli interakcji wirusów i organizmów komórkowych w ewolucji obu. Wirusy i komórki „uczą się” siebie nawzajem, a zdobyta „wiedza” jest dziedziczona. W 2013 roku dwóch absolwentów Wydziału Wirusologii Moskiewskiego Uniwersytetu Państwowego, Evgeny Kunin i Valeryan Dolya, opublikowało artykuł na temat „wirocentrycznego” spojrzenia na ewolucję, zgodnie z którym oporność i współpraca wirusów i organizmów komórkowych jest głównym czynnikiem ich ewolucję.
Moja historia nie wyczerpuje tematu: o naturze patogeniczności wirusów wiadomo znacznie więcej. Wiele z tego, co obecnie wiemy, nauczyliśmy się w ostatnich latach i istnieją podstawy, aby spodziewać się nowych niespodzianek. Możemy i powinniśmy winić wirusy za poważne choroby i należy z nimi walczyć, ale powinniśmy być wdzięczni wirusom za istnienie i różnorodność przyrody żywej, w tym istnienie człowieka.
Autor wyraża wdzięczność swoim współpracownikom ze współpracy naukowej – pracownikom Instytutu Poliomyelitis i Wirusowego Zapalenia Mózgu im. M. P. Chumakov RAMS, Moskiewski Uniwersytet Państwowy. M.V. Łomonosow, Instytut Białka RAS (Pushchino, obwód moskiewski), Uniwersytet w Bazylei (Szwajcaria), Uniwersytet Wisconsin (USA), Uniwersytet w Nijmegen. Radboda (Holandia).
Artykuł powstał na podstawie wykładu wygłoszonego w szkole „Nowoczesna biologia i biotechnologie przyszłości” (Zvenigorod, 26 stycznia - 1 lutego 2014 r.).
. Belov G. A., Lidsky P. V., Mikitas O. V. i in. Dwukierunkowy wzrost przepuszczalności otoczki jądrowej po zakażeniu wirusem polio i towarzyszące mu zmiany porów jądrowych // J. Wirol. 2004. V. 78. s. 10166–10177. doi:10.1128/JVI.78.18.10166-10177.2004. Lidsky P. V., Hato S., Bardina M. V. i in. Nukleocytoplazmatyczne zaburzenie ruchu wywołane przez kardiowirusy // J. Wirol. 2006. V. 80. s. 2705–2717. doi:10.1128/JVI.80.6.2705-2717.2006
. Bardina M. V., Lidsky P. V., Sheval E. V. i in. Wywołana przez mengowirusa rearanżacja kompleksu porów jądrowych: przejęcie kontroli nad maszynerią fosforylacji komórkowej // J. Wirol. 2009. V. 83. s. 3150–3161. doi:10.1128/JVI.01456-08
. Mikitas O. V., Ivin Y. Y., Golyshev SA i in. Tłumienie obrażeń spowodowanych przez wirusa litycznego RNA (mengowirus) i ich oddzielenie od reprodukcji wirusa poprzez wzajemne rozbrojenie komórek/wirusów // J. Wirol. 2012. V. 86. s. 5574–5583. doi:10.1128/JVI.07214-11
. Agol V. I., Belov G. A., Bienz K. i in. Konkurencyjne programy śmierci w komórkach zakażonych wirusem polio: zmiana zaangażowania w środku cyklu zakaźnego // J. Wirol. 2000. V. 74. s. 5534–5541. doi:10.1128/JVI.74.12.5534-5541.2000
. Agol V. I. Efekty cytopatyczne: modulowane przez wirusy objawy wrodzonej odporności? // Trendy Microbiol. 2012. V. 20. S. 570–576. doi:10.1016/j.tim.2012.09.003
. Koonin E. V., Dolja V. V. Wirocentryczne spojrzenie na ewolucję życia // Aktualny Opinia. Wirol. 2013. V. 3. s. 546–557. doi:10.1016/j.coviro.2013.06.008